MRT der Sakroiliakalgelenke und Wirbelsäule bei jungen Gesunden
Die MRT-Untersuchung von Sakroiliakalgelenken und der Wirbelsäule spielt wohl die wichtigste Rolle bei der Diagnose und Differenzialdiagnose einer axialen SpA. In der Vergangenheit wurde eine hohe Spezifität von MRT-Befunden insbesondere in den Sakroiliakalgelenken angenommen, aber in letzter Zeit auch immer wieder infrage gestellt. Xenofon Baraliakos und Koautoren untersuchten nun die Häufigkeit von SpA-typischen MRT-Veränderungen in den Sakroiliakalgelenken und in der Wirbelsäule bei jungen Erwachsenen (Alter <45 Jahre) aus der deutschen SHIP (Study of Health in Pomerania)-Kohorte. Hierin wurden die MRT-Aufnahmen von 793 gesunden jungen Erwachsenen ausgewertet. (1)
Ein Knochenmarködem passend zu SpA wurde bei 136 Probanden (17,2 %) in den Sakroiliakalgelenken und bei 218 Probanden (27,5 %) in der Wirbelsäule gefunden. HLA-B27-Positivität, Rückenschmerzen und ein höherer Body Mass-Index (BMI) waren die wichtigsten Parameter, die mit dem Knochenmarködem in den Sakroiliakalgelenken assoziiert waren. Somit ist es vorstellbar, dass bei einem Teil der Patienten das Ödem aufgrund einer nicht diagnostizierten SpA vorhanden war, und bei einem anderen Teil infolge mechanischer Probleme bzw. Überlastung entstand. Das Knochenmarködem in der Wirbelsäule war nur mit einem höheren Alter assoziiert, was neben der hohen Prävalenz des Befundes auf eine geringe Spezifität und eine überwiegend mechanische Genese hinweist.
Neue Studien mit IL-17-Blockern bei nicht-röntgenologischer axialer SpA
Bis jetzt sind formal lediglich TNFα-Blocker für die Indikation „nicht-röntgenologische axiale Spondyloarthritis“ (nr-axSpA) zugelassen. Auf dem ACR-Kongress wurden nunmehr gleich zwei randomisierte, doppelblinde, placebokontrollierte Phase-III-Studien mit den IL-17A-Inhibitoren Secukinumab (2) und Ixekizumab (3) in dieser Indikation vorgestellt.
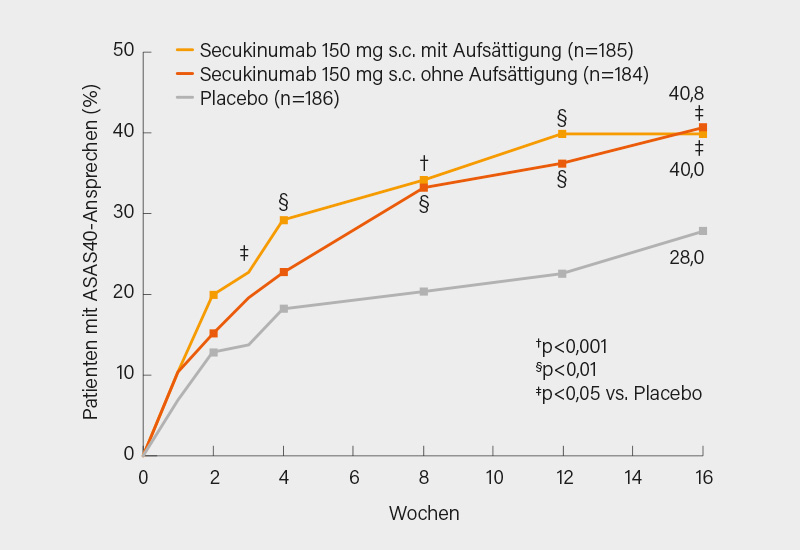
In der PREVENT-Studie mit Secukinumab wurden 555 Erwachsene mit einer etablierten Diagnose einer axialen SpA eingeschlossen, die die ASAS-Klassifikationskriterien (aber nicht die modifizierten New York-Kriterien) erfüllten und einen BASDAI ≥4 sowie objektive Zeichen der entzündlichen Aktivität (Knochenmarködem im MRT der Sakroiliakalgelenke oder erhöhtes C-reaktives Protein, CRP) hatten. Die Patienten wurden randomisiert (1:1:1) auf subkutanes Secukinumab 150 mg (mit Aufsättigung), 150 mg (ohne Aufsättigung) oder Placebo. Die Aufsättigungs-Gruppe erhielt Secukinumab 150 mg zum Studienbeginn, in Woche 1, 2, 3 und 4, und dann alle 4 Wochen (Q4W) bis Woche 52. Die Gruppe ohne Aufsättigung erhielt Secukinumab 150 mg zu Baseline und Placebo zu Woche 1, 2 und 3, und in der Folge dann Secukinumab 150 mg Q4W ab Woche 4. Die Placebo-Gruppe erhielt Placebo zu Baseline, in den Wochen 1, 2, 3 und 4 und dann Q4W. Der primäre Endpunkt war das ASAS40-Ansprechen zu Woche 16 (wird hier berichtet) und zu Woche 52. Der primäre und alle sekundären Endpunkte wurden erreicht. Zu Woche 16 war das ASAS40-Ansprechen mit 40,8 bzw. 40,0 % in beiden Secukinumab-Gruppen signifikant höher als in der Placebo-Gruppe mit 28,0 % (p<0,05) (Abb. 1). Auch in den sekundären Endpunkten wie etwa dem BASDAI50-Ansprechen (37,3 und 37,5 vs. 21,0 %), der ASAS partiellen Remission (21,6 und 21,2 vs. 7,0 %), im Verlauf von BASDAI, BASFI, SF-36 PCS oder der Lebensqualität (ASQoL) von Baseline bis Woche 16 erwies sich Secukinumab als signifikant überlegen (alle p<0,05). Es bestanden keine relevanten Unterschiede mit oder ohne vorherige Aufsättigung. (2)
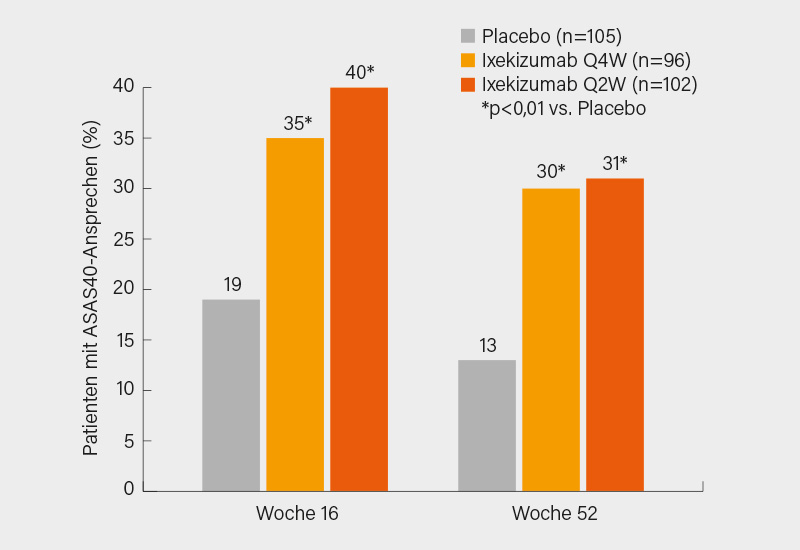
In der COAST-X-Studie mit Ixekizumab waren die Einschlusskriterien sehr ähnlich. In diese wurden insgesamt 303 Erwachsene mit einer etablierten Diagnose einer axialen SpA eingeschlossen, die wiederum die ASAS-Klassifikationskriterien (aber nicht die modifizierten New York-Kriterien) erfüllten, einen BASDAI ≥4 sowie objektive Zeichen der entzündlichen Aktivität (Knochenmarködem im MRT der Sakroiliakalgelenke oder erhöhtes CRP >5 mg/L) aufweisen mussten. Diese Patienten wurden randomisiert 1:1:1 auf subkutanes Ixekizumab 80 mg alle 4 Wochen (Q4W), 80 mg Ixekizumab alle 2 Wochen (Q2W) oder Placebo. Primärer Endpunkt war das ASAS40-Ansprechen zu Woche 16 sowie 52. Signifikant mehr Patienten unter Ixekizumab erreichten ein ASAS40-Ansprechen zu Woche 16 (35 und 40 vs. 19 %) und Woche 52 (30 und 31 vs. 13 %; je p<0,01) verglichen mit Placebo (Abb. 2). Ähnliche Unterschiede sah man auch bei allen sekundären Endpunkten, so im Verlauf von ASDAS, BASDAI, BASFI sowie SF-36-PCS, einschließlich der Reduktion des CRP-Werts sowie der Entzündung in der MRT (SPARCC-Score). Im Trend schnitt die Ixekizumab-Applikation alle 2 Wochen stets minimal besser als die 4-wöchentliche Gabe ab. (3)
In beiden Phase-III-Studien erwies sich die IL-17-Blockade somit als wirksam auch bei Patienten mit nicht-röntgenologischer axialer SpA. Allerdings war in beiden Studien (insbesondere in PREVENT) das Placebo-Ansprechen wesentlich höher als in den früheren Studien bei der AS. Weitere Analysen sollten die Ursachen des hohen Placebo-Ansprechens in den beiden Studien genau untersuchen. Von einer Zulassungserweiterung auf die nr-axSpA dürfte in beiden Fällen aber auszugehen sein.
Ein weiterer JAK-Inhibitor effektiv auch bei der axialen SpA
Zwei JAK-Inhibitoren (der Pan-JAK-Inhibitor Tofacitinib und JAK-1-Inhibitor Filgotinib) zeigten bereits im Rahmen von Phase-II-Studien eine gute klinische Wirksamkeit bei der axialen SpA. Auf dem ACR-Kongress wurden nunmehr die Daten der randomisierten, doppelblinden, placebokontrollierten Phase-II/III-Studie SELECT-AXIS 1 bei der röntgenologischen axialen SpA (=AS) mit dem JAK-1-Inhibitor Upadacitinib (der bereits für die Indikation rheumatoide Arthritis in den USA und kürzlich auch der EU zugelassen wurde) präsentiert. (4)
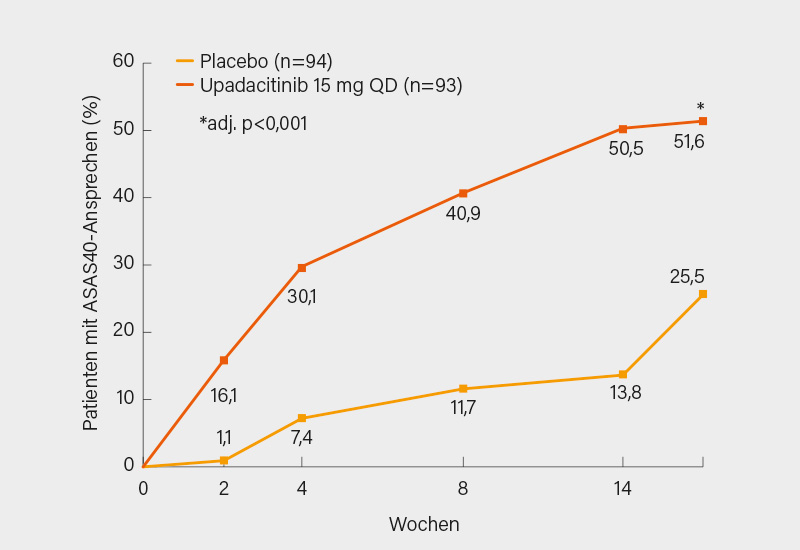
Insgesamt 187 erwachsene Patienten mit aktiver AS (BASDAI ≥4, Rückenschmerz ≥4 auf VAS 0-10) wurden 1:1 auf Upadacitinib 15 mg (1x täglich) oder Placebo randomisiert. Die eingeschlossenen Teilnehmer erfüllten die modifizierten New York-Kriterien für AS, hatten auf ≥2 NSAR versagt und waren Biologika-naiv. Der primäre Endpunkt war das ASAS40-Ansprechen zu Woche 14. Signifikant mehr mit Upadacitinib gegenüber Placebo behandelte AS-Patienten erreichten den primären Endpunkt des ASAS40-Ansprechens zu Woche 14 (51,6 vs. 25,5 %; p<0,001) (Abb. 3). Auch sekundäre Endpunkte (z. B. BASDAI50, ASAS partielle Remission, ASDAS-Verlauf) wurden erreicht, darunter eine stärkere Verbesserung der aktiven Entzündung im MRT (SPARCC-Score) unter Upadacitinib versus Placebo. Somit zeigte bereits der dritte JAK-Inhibitor eine klinische Wirksamkeit bei der axialen SpA. Aktuell wird die Wirksamkeit dieser Medikamentenklasse in größeren Phase-III-Studien in dieser Indikation untersucht; bei bestätigter Effektivität können wir mit der Zulassung der Medikamentengruppe (auch) für die axiale SpA rechnen.
Psoriasis-Arthritis: Zwei Phase-III-Studien zu IL-23-Hemmer Guselkumab
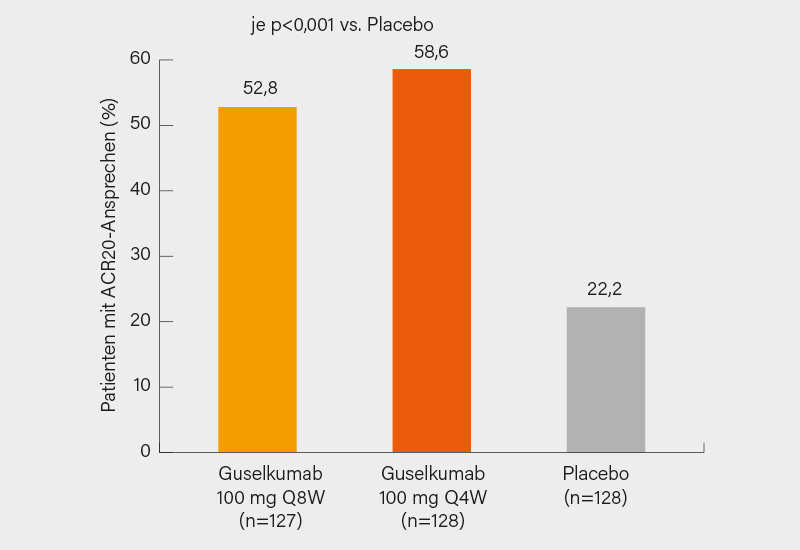
Der bei Plaque-Psoriasis zugelassene, selektiv gegen IL-23p19 gerichtete monoklonale Antikörper Guselkumab hatte bereits in Phase-II bei PsA vielversprechende Daten geliefert. In Atlanta wurden nun die beiden randomisierten, doppelblinden, placebokontrollierten Phase-III-Studien DISCOVER-1 (5) und DISCOVER-2 (6) vorgestellt. In DISCOVER-1 wurden 381 Biologika-naive oder mit TNFα-Inhibitoren (ca. 30 %) vorbehandelte Patienten mit trotz Standardtherapie aktiver PsA (≥3 geschwollene/schmerzhafte Gelenke, CRP ≥0,3 mg/dl) eingeschlossen und 1:1:1 auf subkutanes Guselkumab 100 mg alle 4 Wochen (Q4W), Guselkumab 100 mg in Woche 0 und 4 und dann alle 8 Wochen (Q8W mit Aufsättigung) oder Placebo randomisiert. Primärer Endpunkt war das ACR20-Ansprechen in Woche 24. Diesen erreichten signifikant mehr Patienten mit Guselkumab Q4W und Q8W (58,6 und 52,8 vs. 22,2 % unter Placebo; je p<0,001) (Abb. 4), eine Anti-TNF-Vortherapie hatte dabei keinen wesentlich Einfluss auf das Ansprechen. Eine Überlegenheit zeigte sich auch in sekundären Enpunkten wie etwa im Investigator’s Global Assessment (IGA) Psoriasis-Ansprechen (75,3 und 57,3 vs. 15,4 %) sowie im HAQ-DI, SF-36 PCS, ACR50/70- und PASI75/90/100-Ansprechen und auch dem Erreichen einer minimalen Krankheitsaktivität (MDA) in Woche 24 (alle p<0,001). (5)
In DISCOVER-2 wurden 739 Biologika-naive Patienten mit aktiver PsA (≥5 geschwollene/schmerzhafte Gelenke, CRP ≥0,6 mg/dl) eingeschlossen und auf Guselkumab 100 mg Q4W oder Q8W (mit Aufsättigung) oder Placebo randomisiert. Primärer Endpunkt war erneut das ACR20-Ansprechen in Woche 24, als sekundärer Endpunkt wurde die radiologische Progression im PsA-modifizierten van der Heijde-Sharp (vdH-S)-Score von Woche 0 bis 24 erfasst. Anhand gepoolter Daten aus DISCOVER-1 und -2 wurde zudem der Therapieeffekt auf Enthesitis und Daktylitis bestimmt. Mit Guselkumab Q4W und Q8W wurde ein signifikant höheres ACR20-Ansprechen in Woche 24 als unter Placebo verzeichnet (63,7 und 64,1 vs. 32,9 %; je p<0,001). Signifikante Verbesserungen wurden mit Guselkumab Q4W in fast allen sekundären Endpunkten inklusive vdH-S-Score erzielt. Signifikante Vorteile beider Regime wurden beim ACR50/70- sowie PASI75/90/100-Ansprechen und dem Erreichen einer MDA in Woche 24 gesehen (alle p<0,001) sowie hinsichtlich einer vollständigen Resolution von Daktylitis und Enthesitis. Das Sicherheitsprofil entsprach jenem aus den Studien zur Plaque-Psoriasis. (6)
Ähnlich wie TNFα- und IL-17A-Inhibitoren zeigt Guselkumab als IL-23-Hemmer eine bei PsA breite Wirksamkeit auf Gelenke, Haut, Enthesitis und Daktylitis mit einer – analog zur IL-17-Hemmung – besonders guten Effektivität auf die Psoriasis. Von einer späteren Zulassung auch in dieser neuen Indikation dürfte angesichts der Ergebnisse aus DISCOVER-1- und -2 auszugehen sein, wobei die 4-wöchentliche Applikation ohne Aufsättigung womöglich das bevorzugte Behandlungsregime sein dürfte. Das Therapiespektrum bei PsA dürfte sich somit noch verbreitern, auch mit (jenseits des in dieser Indikation zugelassenen Tofacitinib) weiteren JAK-Inhibitoren, die derzeit in Phase-III-Studien evaluiert werden, dürfte zu rechnen sein.
Quellen:
1 Baraliakos X et al., Arthritis Rheumatol 2019; 71(Suppl10): Abstract 573
2 Deodhar A et al., Arthritis Rheumatol 2019; 71(Suppl10): Abstract L21
3 Deodhar A et al., Arthritis Rheumatol 2019; 71(Suppl10): Abstract 2729
4 van der Heijde D et al., Arthritis Rheumatol 2019; 71(Suppl10): Abstract 2728
5 Deodhar A et al., Arthritis Rheumatol 2019; 71(Suppl10): Abstract 807
6 Mease PJ et al., Arthritis Rheumatol 2019; 71(Suppl10): Abstract L13
Prof. Dr. med. Denis Poddubnyy
Leiter der Rheumatologie am Campus Benjamin Franklin -
Medizinische Klinik für Gastroenterologie, Infektiologie und Rheumatologie
Charité – Universitätsmedizin Berlin
Hindenburgdamm 30, 12203 Berlin