In der von Atul Deodhar, Portland (USA), und Kollegen, vorgestellten DISCOVER-1-Studie wurden 381 Biologika-naive oder bereits mit TNFα-Inhibitoren (ca. 30 % mit 1-2 Anti-TNF-Vortherapien) vorbehandelte Patienten mit trotz einer Standardtherapie (inadäquates Ansprechen auf Apremilast für ≥4 Monate, auf csDMARDs für ≥3 Monate und NSAR für ≥4 Wochen) aktiven PsA (SJC/JC je ≥3, CRP ≥0,3mg/dl) eingeschlossen und im Verhältnis 1:1:1 auf subkutanes (s.c.) Guselkumab 100 mg alle 4 Wochen (q4w), Guselkumab 100 mg in Woche 0 und 4 und dann alle 8 Wochen (q8w mit Aufsättigung) oder Placebo randomisiert. Primärer Endpunkt war das ACR20-Ansprechen in Woche 24 (mit Non-Responder Imputation).
DISCOVER-1 und -2: Guselkumab punktet
Ein ACR20-Ansprechen in Woche 24 erreichten signifikant mehr Patienten mit Guselkumab q4w und q8w (59 und 52 vs. 22,2 % unter Placebo; je p<0,001) – ohne klarem Unterschied mit oder ohne Anti-TNF-Vortherapie. Eine Überlegenheit zeigte sich auch in sekundären Enpunkten wie etwa im Investigator’s Global Assessment (IGA) Psoriasis-Ansprechen (75 und 57 vs. 15 %) sowie im HAQ-DI, SF-36 PCS, ACR50/70- und PASI75/90/100-Ansprechen und dem Erreichen einer minimalen Krankheitsaktivität (MDA) in Woche 24 (alle p<0,001). Das Sicherheitsprofil war gut, schwere unerwünschte Ereignisse (UE) waren bis Woche 24 seltener als unter Placebo, es kam zu keiner schweren Infektion unter Guselkumab. (1)
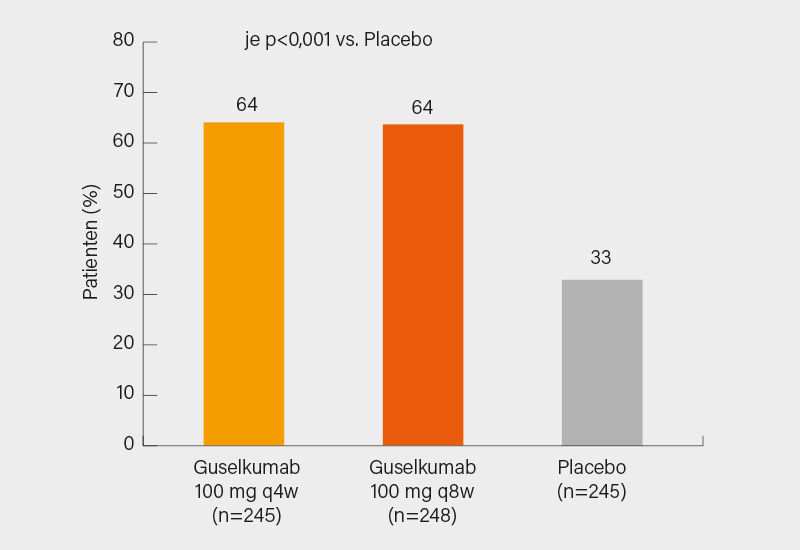
In die von Philip J. Mease, Seattle (USA), und Kollegen vorgelegte DISCOVER-2-Studie wurden 739 Biologika-naive Patienten mit (vs. DISCOVER-1) stärker aktiver PsA (SJC/JC je ≥5, CRP ≥0,6 mg/dl) eingeschlossen und wiederum im Verhältnis 1:1:1 auf s.c. Guselkumab 100 mg q4w oder q8w (mit Aufsättigung) oder Placebo randomisiert. Primärer Endpunkt war wieder das ACR20-Ansprechen in Woche 24, als sekundärer Endpunkt wurde zusätzlich die radiologische Progression im PsA-modifizierten van der Heijde-Sharp (vdH-S)-Score von Woche 0 bis 24 erfasst. Überdies wurde mittels gepoolter Daten aus DISCOVER-1- und -2 die Resolution von Enthesitis und Daktylitis bestimmt. Mit Guselkumab q4w und q8w wurde im primären Endpunkt ein signifikant höheres ACR20-Ansprechen in Woche 24 gegenüber Placebo verzeichnet (je 64 vs. 33 %, je p<0,001) (Abb.). Signifikante Verbesserungen in den sekundären Endpunkten wurden hier vorrangig mit Guselkumab q4w erzielt, so auch im ΔPsA-modifizierten vdH-S bis Woche 24. Signifikante Vorteile beider Guselkumab-Regime wurden beim ACR50/70- sowie PASI75/90/100-Ansprechen und dem Erreichen einer MDA in Woche 24 gesehen (alle p<0,001), gleiches gilt für eine vollständige Resolution von Daktylitis und Enthesitis. Das Sicherheitsprofil des IL-23-Inhibitors war erneut gut, die Rate schwerer UE war auf Placeboniveau und es wurde nur eine schwere Infektion verzeichnet. (2)
Kompakt: Ähnlich wie TNFα- und IL-17A-Inhibitoren zeigt Guselkumab als IL-23-Hemmer eine bei PsA breite Wirksamkeit auf Gelenke, Haut, Enthesitis und Daktylitis mit einer – analog zur IL-17-Hemmung – besonders guten Effektivität auf die Psoriasis. Von einer Zulassung auch bei PsA dürfte angesichts der positiven Ergebnisse aus DISCOVER-1- und -2 und der erneut gezeigten guten Verträglichkeit auszugehen sein, wobei die 4-wöchentliche Applikation ohne Aufsättigung womöglich das bevorzugte Behandlungsregime sein dürfte.
Quellen:
1 Lancet 2020; 395(10230): 1115-1125
2 Lancet 2020; 395(10230): 1126-1136