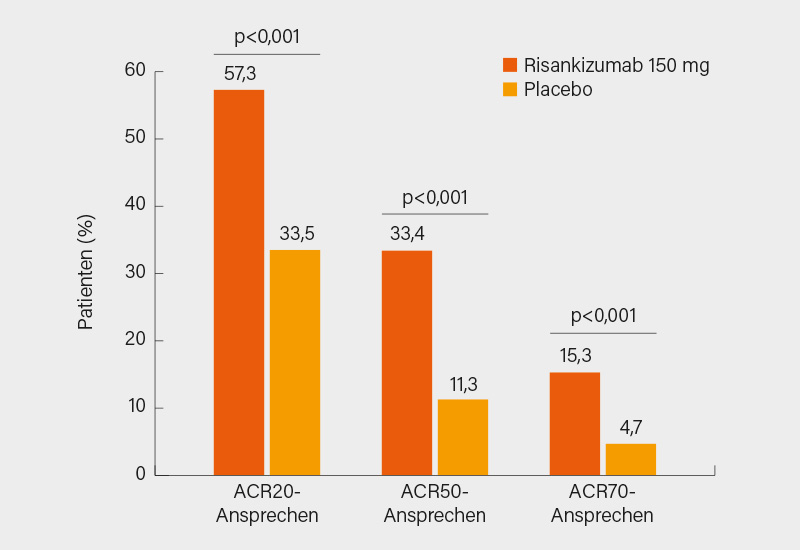
Zunächst zur randomisierten, doppelblinden, placebokontrollierten Phase-III-Studie KEEPsAKE-1, deren Ergebnisse Erik Kristensen, Kopenhagen (Dänemark), und Kollegen veröffentlichten. Die Studie evaluierte Risankizumab bei Patienten mit aktiver PsA (SJC und TJC ≥5) und einem unzureichenden Ansprechen oder Unverträglichkeit von ≥1 csDMARD. 964 Patienten (im Mittel Krankheitsdauer 7,1 Jahre, SJC 12,2, TJC 20,6, bei jenen mit ≥3 % von Psoriasis betroffener Körperoberfläche [BSA] betrug die BSA 16,7 %) wurden im Verhältnis 1:1 auf s.c. Risankizumab 150 mg oder Placebo in Woche 0, 4 und 16 randomisiert. Primärer Endpunkt war das ACR20-Ansprechen in Woche 24. In einer sich anschließenden Open-label-Phase der Studie erhielten alle Patienten Risankizumab. Der primäre ACR20-Endpunkt in Woche 24 wurde signifikant erreicht (57,3 vs. 33,5 %; p<0,001), ein ACR50/70-Ansprechen fand sich bei 33,4 vs. 11,3 % bzw. 15,3 vs. 4,7 % (je p<0,001) der Patienten (Abb. 1). Den sekundären Endpunkt ACR20 in Woche 16 erreichten 56,3 vs. 33,4 % der Teilnehmer (p<0,001). In den ersten 8 hierarchisch getesteten sekundären Endpunkten waren signifikante Vorteile von Risankizumab in Woche 24 evident, so im ΔHAQ-DI (-0,3 vs. 0,1), PASI 90-Ansprechen (52,3 vs. 9,9 %), Erreichen einer minimalen Krankheitsaktivität (MDA) (25,0 vs. 10,2 %), Nagelpsoriasis im mNAPSI-Score (-9,8 vs. 5,6) und Resolution von Enthesitis (48,4 vs. 34,8 %) und Daktylitis (68,1 vs. 51,0 %) (je p<0,001). Das Sicherheitsprofil war gut mit einer Rate therapieassoziierter unerwünschter Ereignisse (TEAE) auf Placeboniveau (40,4 vs. 38,7 %), zu einem Abbruch führende TEAE waren gleich verteilt (je 0,8 %). Die Rate schwerer unerwünschter Ereignisse (AE) war in beiden Armen vergleichbar (2,5 vs. 3,7 %), ebenso jene für schwere Infektionen (1,0 vs. 1,2 %). (1)
Risankizumab: Positives Fazit aus KEEPsAKE-1 und -2
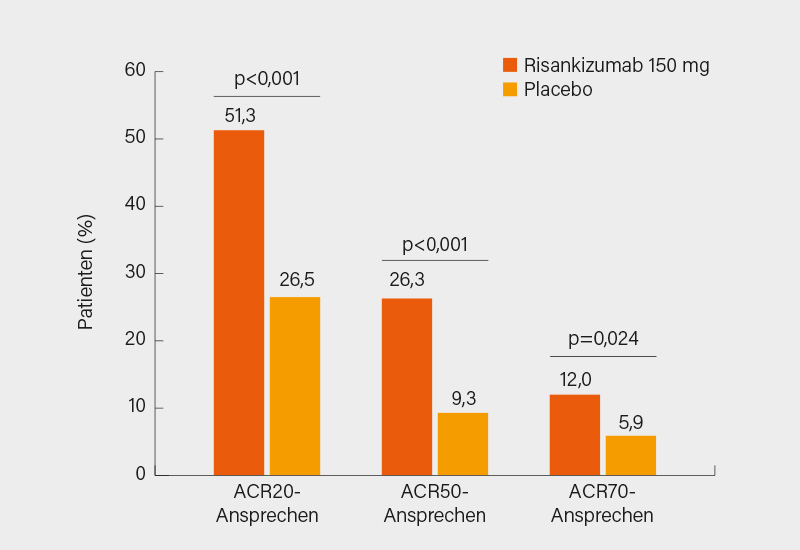
Fast parallel veröffentlichten Andrew Östör, Melbourne (Australien), und Kollegen die Daten der randomisierten, doppelblinden, placebokontrollierten Phase-III-Studie KEEPsAKE-2. In dieser zweiten, kleineren Zulassungsstudie wurden 444 Patienten mit aktiver PsA (SJC/TJC ≥5) und unzureichendem Ansprechen oder Unverträglichkeit von 1-2 bDMARDs (46,5 %) und/oder ≥1 csDMARD für 24 Wochen im Verhältnis 1:1 auf s.c. Risankizumab 150 mg oder Placebo in Woche 0, 4 und 16 randomisiert (medianes Alter 53 Jahre, mittlere Krankheitsdauer 8,2 Jahre, SJC 13,3, TJC 22,6, bei jenen mit einer von Psoriasis betroffenen BSA ≥3 % betrug diese 12,1 % zu Baseline). Der primäre Endpunkt eines ACR20-Ansprechens in Woche 24 wurde signifikant erreicht (51,3 vs. 26,5 %; p<0,001), das ACR50/70-Kriterium erfüllten 26,3 vs. 9,3 % (p<0,001) bzw. 12,0 vs. 5,9 % (p=0,024) der Patienten unter Risankizumab bzw. Placebo (Abb. 2). Auch alle hierarchisch getesteten sekundäre Endpunkte wurden signifikant erreicht: ΔHAQ-DI -0,22 vs. -0,05, PASI 90-Ansprechen 55,0 vs. 10,2 %, MDA 25,6 vs. 11,4 %, ΔSF-36 PCS 5,9 vs. 2,0 (je p<0,001) und ΔFACIT-F 4,9 vs. 2,6 (p=0,009). Bei der Resolution von Enthesitis (42,9 vs. 30,4 %; p<0,01) und Daktylitis (72,5 vs. 42,1 %; p<0,001) in Woche 24 zeigte sich Risankizumab ebenfalls signifikant überlegen. Das Sicherheitsprofil war gut mit einer TEAE-Rate auf Placeboniveau (55,4 vs. 54,8 %), zu schweren AE kam es bei 4,0 vs. 5,5 %, schweren TEAE bei 2,7 vs. 3,2 % und schweren Infektionen bei 0,9 vs. 2,3 % der Patienten. Wie Guselkumab scheint sich auch Risankizumab durch eine besonders gute Verträglichkeit auszuzeichnen. Die Studie bestätigt somit in Erweiterung zu KEEPsAKE-1 mit csDMARD-Vortherapien nun auch in einem Kollektiv, das zu fast 50 % bDMARD-erfahren war, die gute und breite Wirksamkeit von Risankizumab auf relevante PsA-Domänen auch jenseits der Haut. (2)
Guselkumab: Dritte positive Phase-III-Studie vorgestellt
Nachdem der erste bei PsA zugelassene IL-23-Inhibitor Guselkumab bereits in den beiden Phase-III-Zulassungsstudien DISCOVER-1 und -2 überzeugt hatte, veröffentlichten nun Laura C. Coates, Oxford (Großbritannien) und Kollegen, die Ergebnisse der randomisierten, doppelblinden, placebokontrollierten Phase-IIIb-Studie COSMOS, in die (anders als in DISCOVER-1) explizit nur Patienten mit inadäquatem Ansprechen auf TNFα-Inhibitoren eingeschlossen wurden. 285 Patienten mit aktiver PsA (SJC und TJC ≥3) und Versagen auf oder Unverträglichkeit von 1 oder 2 TNFα-Inhibitoren (88 bzw. 12 %) wurden im Verhältnis 2:1 auf s.c. Guselkumab 100 mg oder Placebo in Woche 0, 4 und dann alle 8 Wochen bis Woche 44 randomisiert mit Placebo-Crossover zu Guselkumab in Woche 24; bei <5 % Verbesserung im SJC und TJC war bereits ab Woche 16 ein „early espape“ (EE) auf Guselkumab gestattet. Im Mittel waren die Patienten 49 Jahre alt, die Krankheitsdauer betrug 8,4 Jahre, der SJC/TJC ca. 10 bzw. 20, 52 % waren Frauen, 84 % beendeten die Anti-TNF-Vortherapie aufgrund Ineffektivität (auf Methotrexat, MTX, waren zu Baseline 55 % der Patienten).
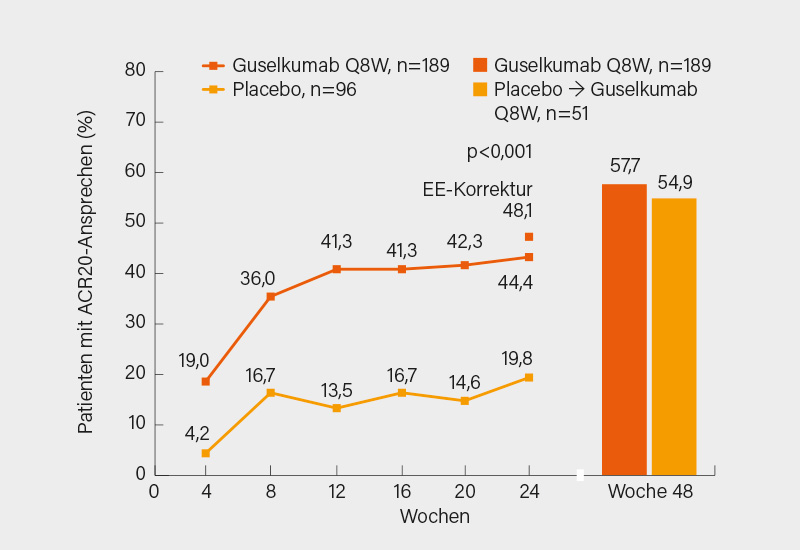
Den primären Endpunkt eines ACR20-Ansprechens in Woche 24 erreichten nach EE-Korrektur (mit Non-Responder Imputation) 48,1 vs. 19,8 % (per-Protokoll 48,8 vs. 23,8 %) unter Guselkumab bzw. Placebo (p<0,001), bis Woche 48 stieg das Ansprechen auf 57,7 bzw. 54,9 % (kontinuierlich Guselkumab oder später darauf gewechselt) (Abb. 3). Das Ergebnis war konsistent in allen Subgruppen und nicht abhängig davon, ob die Anti-TNF-Vortherapie aufgrund Ineffektivität oder Unverträglichkeit beendet wurde. Signifikante Vorteile zeigten sich in Woche 24 nach EE-Korrektur auch im ΔHAQ-DI (-0,22 vs. -0,01; in Woche 48 bei durchgehender Guselkumab-Gabe -0,40), ΔSF-36 PCS (4,28 vs. -0,39; Woche 48 7,02), PASI 100-Ansprechen (33,8 vs. 3,8 %; Woche 48 53,4 %), ACR50 (21,2 vs. 5,2 %; Woche 48 39,2 %) und der Resolution von Enthesitis im Leeds Enthesitis Index (LEI) (39,7 vs. 18,8 %; Woche 48 55,6 %) und der Daktylitis (44,8 vs. 25,0 %; Woche 48 67,2 %). Bei gutem Sicherheitsprofil erwies sich sich Guselkumab auch in diesem Patientenkollektiv als gut wirksam mit bei steigender Therapiedauer zunehmendem Behandlungserfolg. (3)
Aktuelle Daten zu Upadacitinib
Eine gepoolte Analyse von Peter Nash, Brisbane (Australien), und Kollegen befasste sich mit Upadacitinib als Monotherapie oder in Kombination mit nicht-biologischen (nb)DMARDs bei PsA-Patienten mit unzureichendem Ansprechen oder Unverträglichkeit von ≥1 nbDMARD (SELECT-PsA 1) oder ≥1 bDMARD (SELECT-PsA 2), die für 24 Wochen Placebo, Upadacitinib 1x 15 (zugelassene Dosis) oder 30 mg/Tag als Monotherapie oder Kombination mit ≤2 nbDMARDs erhalten hatten. Eingeschlossen waren 1.916 Patienten, davon 30 % mit Mono- und 70 % mit Kombinationstherapie. Nach Bereinigung auf die Placebowirkung betrugen die Therapieeffekte beim ACR20 in Woche 12 für Upadacitinib 15 mg 33,7 (Mono) bzw. 34,0 % (Kombi) sowie für Upadacitinib 30 mg 45,7 bzw. 39,6 %. Die placebo-bereinigten Therapieeffekte unter der Mono- und Kombinationstherapie waren auch im Hinblick auf andere Endpunkte vergleichbar, gleiches galt zumeist auch für die Rate an AE, wobei Leberfunktionsstörungen und Erhöhungen des Kreatin-Kinase (CK)-Werts häufiger bei Anwendung einer Kombinationstherapie auftraten. Als Fazit kann somit gezogen werden, dass bei vielen Patienten unter Upadacitinib vermutlich auf eine Kombination mit csDMARDs verzichtet werden kann, ohne dass mit relevanten Wirkeinbußen zu rechnen ist. (4)
Quellen:
1 Ann Rheum Dis 2022; 81(2): 225-231
2 Ann Rheum Dis 2021; doi: 10.1136/annrheumdis-2021-221048
3 Ann Rheum Dis 2021; doi: 10.1136/annrheumdis-2021-220991
4 Rheumatology 2021; doi: 10.1093/rheumatology/keab905