Zunächst zu der als Late-breaking Abstract vorgestellten internationalen, randomisierten, doppelblinden, placebokontrollierten Phase-III-Studie zu Tofacitinib, in der 269 erwachsene Patienten mit aktiver AS (gemäß den modifizierten New York-Kriterien) und unzureichendem Ansprechen (oder Unverträglichkeit) von ≥2 NSAR für 16 Wochen im Verhältnis 1:1 auf Tofacitinib 2x 5 mg/Tag oder Placebo randomisiert wurden (ca.
83 % Männer, im Mittel 41 Jahre, Krankheitsdauer 13,5 Jahre, ASDAS-CRP 3,8, BASDAI 6,4, 77 % bDMARD-naiv). Im Anschluss erhielten bis Woche 48 auch die Placebo-Patienten open-label Tofacitinib. Jetzt berichtet wurde die Primäranalyse nach Woche 16 (Wirksamkeit) bzw. 48 (Sicherheit).
Tofacitinib mit überzeugenden Daten in Phase-III-Studie
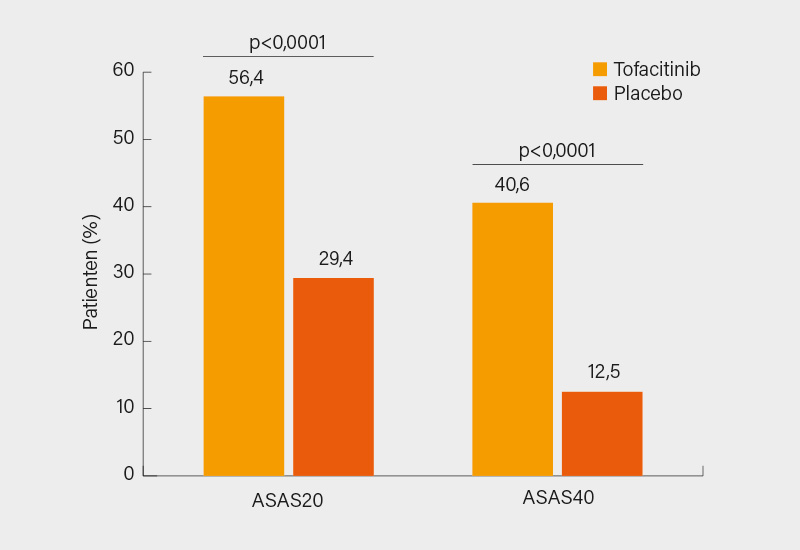
Getestet wurden vier Wirksamkeits-Endpunkt-Cluster in hierarchischer Reihenfolge zur Kontrolle auf Fehler der 1. Art: 1) ASAS20-Ansprechen in Woche 16 (primärer Endpunkt), ASAS40-Ansprechen in Woche 16 (wichtigster sekundärer Endpunkt), Veränderung von Baseline bis Woche 16 (∆) im ASDAS-CRP, hsCRP, ASQoL, SF 36v2 PCS, BASMI und FACIT-F-Score; 2) ∆ bis Woche 16 in ASAS-Komponenten: PtGA, Rückenschmerz, BASFI und Entzündung (Morgensteifigkeit); 3) ASAS20-Ansprechen im zeitlichen Verlauf und; 4) ASAS40-Ansprechen im zeitlichen Verlauf. Den primären Endpunkt ACR20-Ansprechen in Woche 16 erreichten signifikant mehr Patienten auf Tofacitinib (56,4 vs. 29,4 %, p<0,0001). Ebenso überlegen war es im ASAS40-Ansprechen in Woche 16 (40,6 vs. 12,5 %; p<0,0001) (Abb. 1) sowie ∆ASDAS-CRP (-1,46 vs. -0,37), hsCRP (-1,05 vs. -0,09), ASQoL (-4,03 vs. -2,01), SF 36 PCS (6,69 vs. 3,14), BASMI (-0,63 vs. -0,11) und FACIT-F (6,54 vs. 3,12; alle p<0,001), den ASAS-Einzelkomponenten (je p<0,0001) sowie ASAS20/40-Ansprechen im zeitlichen Verlauf (außer ASAS40 in Woche 2; sonst p≤0,0001). Bis Woche 16 kam es bei 54,1 vs. 51,5 % der Patienten unter Tofacitinib bzw. Placebo zu unerwünschten Ereignissen (UE), bei 1,5 vs. 0 % zu schweren UE; 2,3 vs. 0,7 % brachen die Therapie vorzeitig ab. Bis Woche 48 setzten sich diese Sicherheitstrends fort. Bei 3 Patienten kam es zu hepatischen Ereignissen, bei 4 zu Herpes zoster, bei 2 zu schweren Infektionen (eine Meningitis). Es kam weder zu Thormboembolien noch Todesfällen. Insgesamt zeigte Tofacitinib bei bekanntem Sicherheitsprofil bei AS-Patienten ein rasches, klinisch relevantes Ansprechen. Der Weg für eine künftige Zulassung könnte, sobald auch gute Langzeit- und röntgenologische Daten vorliegen, gebahnt sein. (1)
Upadacitinib: Update zur SELECT Axis 1-Studie
In der randomisierten, doppelblinden, placebokontrollierten Phase-II/III-Studie SELECT Axis 1 waren 187 Patienten mit aktiver AS (die modifizierten New York-Kriterien erfüllend, BASDAI ≥4, Rückenschmerz ≥4 auf VAS 0-10, Biologika-naiv, inadäquates Ansprechen auf ≥2 NSAR oder Intoleranz bzw. Kontraindikation gegen NSAR) im Verhältnis 1:1 auf Upadacitinib 15 mg/Tag oder Placebo randomisiert worden. Es handelte es sich zu 71 % um Männer, 76 % waren HLA-B27-positiv, die mittlere Krankheitsdauer betrug 14,4 Jahre, das durchschnittliche Alter 45 Jahre. Ab Woche 14 erhielten alle 178 Teilnehmer, die die randomisierte Studienphase abgeschlossen hatten, Upadacitinib. Bis Woche 64 blieben 160 auf ihrer Therapie. Den primären Endpunkt eines ASAS40-Ansprechens in Woche 14 hatten signifikant mehr der mit Upadacitinib behandelten AS-Patienten (51,6 vs. 25,5 %; p<0,001) erreicht. Auch im Hinblick auf eine ASAS partielle Remission (PR) (19,4 vs. 1,1 %; p<0,001) oder das BASDAI50-Ansprechen (45,2 vs. 23,4 %; p=0,002) sowie eine Reihe weiterer sekundärer Endpunkte (ASDAS, BASFI, BASMI, SPARCC MRT-Index, Enthesitis, Lebensqualität), waren signifikante Vorteile des JAK-1-Inhibitors nachgewiesen worden.
Im weiteren Verlauf bis Woche 64 wurde die Effektivität von Upadacitinib aufrechterhalten bzw. weiter ausgebaut. So erreichten bei kontinuierlicher Upadacitinib-Einnahme 85 bzw. 72 % der Patienten („as-observed“ bzw. mit Non-Responder-Imputation) ein ASAS40-Ansprechen, in der ab Woche 14 auf Upadacininib 15 mg umgestellten Gruppe waren es 81 bzw. 70 %. Ab Woche 14 auf Upadacitinib umgestellte Patienten hatten somit ein genau so rasches und starkes Ansprechen wie von Anfang an mit Upadacitinib behandelte Patienten. Ein ähnliches Bild zeigte sich bei den sekundären Endpunkten, so bei der ASAS partiellen Remission (PR) (46 bzw. 40 % und 39 bzw. 34 %), im BASDAI50-Ansprechen (82 bzw. 77 % und 70 bzw. 67 %) oder dem Erreichen einer ASDAS inaktiven Erkrankung (ID) (44 bzw. 42 % und 36 und 34 %). Bei allen 182 Teilnehmern, die Upadacitinib erhielten (237,6 Patientenjahre, PJ), wurden 618 UE dokumentiert (260,1/100 PJ). Die Rate zu einem Studienabbruch führender und schwerer UE (6,3 bzw. 5,9/100 PJ) war niedrig. Es wurden weder schwere Infektionen, Tuberkulose-Fälle, venöse thromboembolische Ereignisse, gastrointestinale Perforationen, schwere kardiovaskuläre Ereignisse (MACE), renale Dysfunktion noch Todesfälle berichtet.
Im Ergebnis zeigte sich somit bei auf NSAR versagenden, noch Biologika-naiven Patienten mit aktiver AS eine starke, anhaltende und im Verlauf meist noch ansteigende Effektivität von Upadacitinib 15 mg über ein Jahr. Auch erst in Woche 14 auf den JAK-1-Inhibitor umgestellte Patienten profitierten von einem guten Ansprechen, das bis Woche 64 ungefähr das Niveau der von Beginn an mit Upadacitinib behandelten Teilnehmer erreichte. Das Sicherheitsprofil war vergleichbar mit jenem aus den Phase-III-Studien zur rheumatoiden Arthritis und Psoriasis-Arthritis, es wurden keine neuen Sicherheitssignale beobachtet. (2)
Quellen:
1 Arthritis Rheumatol 2020; 72(Suppl. 10): Abstr. L11
2 Arthritis Rheumatol 2020; 72(Suppl. 10): Abstr. 2023