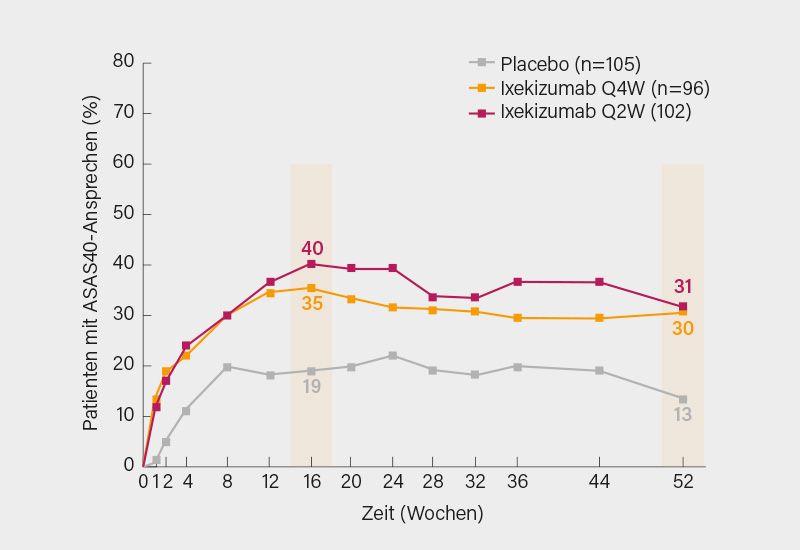
In der COAST-X-Studie wurden insgesamt 303 Patienten mit aktiver nr-axSpA gemäß den ASAS-Klassifikationskriterien, mit einem BASDAI ≥4 und Rückenschmerzen ≥4, objektiven Entzündungszeichen (Sakroiliitis im MRT oder CRP-Wert >5 mg/l) und unzureichendem Ansprechen auf oder Intoleranz von NSAR im Verhältnis 1:1:1 auf Ixekizumab s.c. 80 mg alle 4 Wochen (Q4W) oder alle 2 Wochen (Q2W) oder Placebo randomisiert. Die Teilnehmer waren im Mittel ca. 40 Jahre mit einer durchschnittlichen Krankheitsdauer von 10 Jahren, der BASDAI lag bei 7 und das CRP bei 13 mg/l. Eine Anpassung der Basistherapie mit NSAR, csDMARDs, Analgetika, niedrigdosierten Glukokortikoiden sowie ein open-label Escape auf Ixekizumab Q2W war ab Woche 16 nach ärztlichem Ermessen gestattet. Zusätzlich war nach ≥8 Wochen Ixekizumab Q2W auch eine nachfolgende Escape-Therapie mit einem TNFα-Inhibitor erlaubt. Die primären Endpunkte der Studie waren das ASAS40-Ansprechen in Woche 16 und 52 (mit Non Responder-Imputation, NRI), als sekundäre Endpunkte wurden unter anderem der ASDAS, BASDAI und SPARCC-Score (Sakroilikalgelenke, SIG) erfasst.
Anhaltend gutes ASAS40-Ansprechen
Nach 16 Wochen (40 und 35 vs. 19 %; p=0,0016 bzw. p=0,0094) und auch 52 Wochen (31 und 29 vs. 14 %; p=0,0037 bzw. p=0,0045) erreichten unter Ixekizumab Q2W und Q4W signifikant mehr Patienten gegenüber Placebo den primären Endpunkt eines ASAS40-Ansprechens (Abb.), wobei der Unterschied bereits sehr früh statistisch signifikant war. Ein nicht unerheblicher Anteil jener Patienten, die auf eine offene Therapie mit Ixekizumab Q2W eskaliert wurden, wiesen zum Zeitpunkt des Escape ein ASAS40-Ansprechen auf, das im Verlauf noch weiter anstieg. Eine niedrige Krankheitsaktivität gemäß einem ASDAS <2,1 erreichten wiederum signifikant mehr Patienten unter Ixekizumab Q2W und Q4W in Woche 16 (33 und 26 vs. 13 %) und 52 (jeweils 28 vs. 9 %). Im Vergleich zu Placebo zeigten sich für beide Ixekizumab-Regime auch signifikante Vorteile in den Veränderungen von Baseline bis Woche 16 und 52 im Hinblick auf eine Reihe weiterer Endpunkte wie den ASDAS, BASDAI, BASFI, SF-36 PCS und SPARCC-Score (SIG) mit einer durchweg numerisch etwas höheren Effektivität von Ixekizumab Q2W gegenüber Q4W. Die Anzahl schwerer unerwünschter Ereignisse sowie solcher, die zu einem Abbruch der Therapie führten, war mit 1 % gering und in den drei Armen vergleichbar. Es wurden keine neuen Sicherheitssignale beobachtet.
Im Ergebnis wurden mit beiden Ixekizumab-Regimen somit alle primären und sekundären Endpunkte in puncto Krankheitsaktivität, Symptomatik, körperlicher Funktion und Sakroiliitis im MRT signifikant erreicht. Während die europäische Zulassung von Ixekizumab für die AS noch aussteht, zeichnet sich basierend auf der COAST-X-Studie komplementär dazu dessen künftiger Einsatz auch im nicht-röntgenologischen Stadium ab – von einer Zulassung für die nr-axSpA dürfte sicher auszugehen sein. Damit bietet sich bei Patienten mit signifikanter Entzündung und NSAR-Versagen die Aussicht auf eine wirksame Alternative zu TNFα-Inhibitoren.
Quelle: Lancet 2020; 395(10217): 53-64