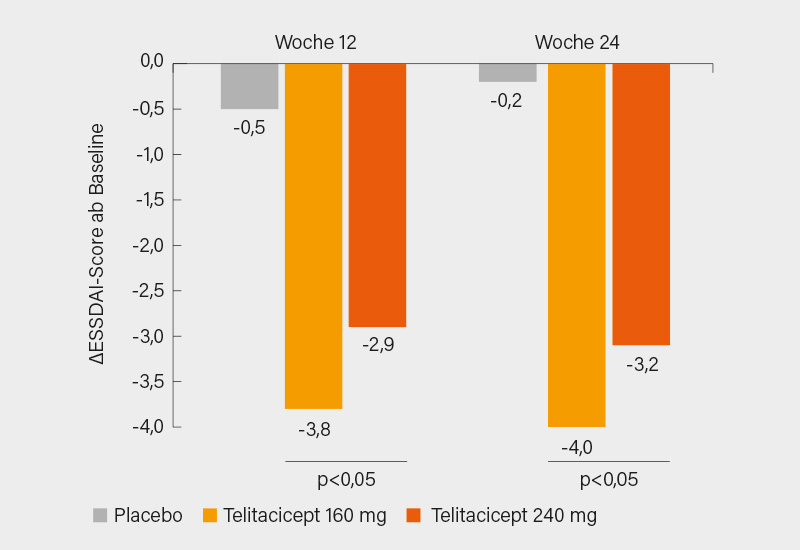
In der Phase-II-Studie zu Telitacicept wurden 42 pSS-Patienten mit anti-SSA-Antikörper-Positivität und einem EULAR Sjögren's Syndrome Disease Activity Index (ESSDAI)-Score ≥5 im 1:1:1-Design für 24 Wochen auf s.c. Telitacicept 240 mg, 160 mg oder Placebo randomisiert (je n=14, Full Analysis Set, FAS) (ca. 95 % Frauen, mittleres Alter 49 Jahre, ESSDAI zu Baseline ca. 9 Punkte, ESSPRI 5 Punkte). Im Per-Protokoll-Set (PPS) wurden 30 Patienten ausgewertet (Telitacicept n=8 bzw. n=12, Placebo n=10). Primärer Endpunkt war die Veränderung im ESSDAI-Score von Baseline bis Woche 24, sekundäre Endpunkte waren unter anderem der EULAR Sjogren's Syndrome Patient Reported Index (ESSPRI) und der Multidimensional Fatigue Inventory (MFI)-20 sowie die Sicherheit.
Im Ergebnis führte Telitacicept 160 mg versus Placebo zu einer signifikanten Verbesserung im ESSDAI in Woche 12 und 24 (FAS, PPS; Δ vs. Placebo >3 Punkte), die höhere Dosierung nur in Woche 12 (FAS) und 24 (PPS) (p<0,05) (Abb. 1). Im ESSPRI zeigten sich in Woche 12 und 24 jeweils nur numerische Vorteile von Telitacicept, die wiederum unter der niedrigeren Dosis etwas ausgeprägter waren. Ebenfalls ein positiver Trend war im Hinblick auf die Funktion der Speichel- (unstimulierter Speichelfluss) und Tränendrüsen (Schirmer-Test) zu erkennen. Zudem kam es zu einer signifikanten Verbesserung von Fatigue (MFI-20; p<0,05) und Reduktion des Serum-IgG-Spiegels bis Woche 24. Schwere unerwünschte Ereignisse (UE) blieben aus, an Infektionen waren vor allem solche der oberen Atemwege zu verzeichnen. Eine Phase–III-Studie zu Telitacicept wurde bereits aufgelegt. (1)
Dazodalibep: Erste Daten aus Studien stimmen zuversichtlich
Im ersten Teil der ALISS-Studie zu Dazodalibep wurden 74 erwachsene SS-Patienten mit mäßiger bis hoher systemischer Krankheitsaktivität (ESSDAI ≥5) im Verhältnis 1:1 für 24 Wochen auf i.v. Dazodalibep 1.500 mg oder Placebo (erst Q2W 3 Dosen, dann Q4W 4 zusätzliche Dosen) randomisiert. Es handelte sich fast durchweg um Frauen, das mittlere Alter betrug 50 Jahre, der mittlere ESSDAI und ESSPRI zu Baseline betrugen 10,7 bzw. 6,6. Ab Tag 169 erfolgte für 16 Wochen ein Crossover: Die Dazodalibep-Gruppe erhielt Placebo und die Placebo-Gruppe Dazodalibep (Q4W 5 Dosen), daran schloss sich eine 12-wöchige (therapiefreie) Nachbeobachtung an. Primärer Endpunkt war die Veränderung im ESSDAI zu Tag 169. Dieser wurde unter Dazodalibep signifikant erreicht mit einer Reduktion um -6,3 vs. -4,1 unter Placebo (Δ -2,2; p=0,0167). Im Vergleich zu Placebo zeigten sich nach 24 Wochen positive Trends in Bezug auf den ESSPRI sowie FACIT-Fatigue-Score. Eine Post-hoc-Responder-Analyse von Teilnehmern, die eine ESSDAI-Verbesserung um 5 bzw. 6 Punkte erreichten, ergab Vorteile für Dazodalibep (61,1/60,0 % vs. 35,1/34,3 %; p<0,05). Die Verträglichkeit war gut, zwei schwere UE wurden nur bei einer Patientin (COVID-19) beobachtet, die später verstarb. (2)
Fast noch interessanter war der zweite Studienteil, der sich mit einer Population mit inakzeptabel hoher Krankheitslast, aber eher geringer systemischer Krankheitsaktivität befasste, die üblicherweise nicht Eingang in klinische Studien findet (94,5 % Frauen, im Mittel 49,9 Jahre). Der Studienaufbau war im Grunde identisch mit jenem der ersten Studie, 1:1 randomisiert auf Dazodalibeb oder Placebo wurden hier 109 Patienten, die aber einen ESSPRI ≥5 und ESSDAI <5 (im Mittel 2,8 zu Baseline) haben mussten (zusätzlich waren ein stimulierter Speichelfluss von ≥0,1 ml/min. gefordert sowie eine höchstens limitierte extraglanduläre Beteiligung). Primärer Endpunkt war diesmal die Veränderung des ESSPRI bis Tag 169. Dieser wurde mit Dazodalibep nach 24 Wochen signifikant erreicht mit einer Reduktion im ESSPRI von -1,80 vs. -0,53 (Δ -1,27; p=0,00002) (Abb. 2). Selbiges galt für jede der drei ESSPRI-Domänen (Trockenheit, p=0,0066; Fatigue, p=0,0022; Schmerz, p=0,0010). Signifikant mehr Patienten erreichten unter Dazodalibep eine Verbesserung im ESSPRI um ≥1 Punkt oder um 15 % gegenüber Placebo (66,7 vs. 32,7 %; p=0,008). Dasselbe galt für die Verbesserung im FACIT-Fatigue-Score bis Tag 169 (8,1 vs. 2,8; p=0,0095). Numerische Vorteile fanden sich im Ocular Surface Disease Index (OSDI: −14,0 vs. −8,5; p=0,1936) und Patientenurteil zur Krankheitsschwere (−0,6 vs. -0,4; p=0,1781). Auch hier war die Verträglichkeit gut mit meist nur milden bis mäßigen UE, drei schwere UE (Pneumonie, COVID-19, Gammopathie) wurden als nicht therapieassoziiert eingestuft. (3)
Zusammengenommen belegen beide Dazodalibep-Studien eine gute Wirksamkeit mit klinisch relevanten Verbesserungen, sodass eine weitere Entwicklung in dieser Indikation Sinn machen dürfte. Eine Phase-III-Studie wurde aber noch nicht angekündigt. Insgesamt ist die Entwicklung beim Sjögren-Syndrom recht erfreulich: Neben Telitacicept befindet sich auch Ianalumab in einer Phase-III-Studie, womöglich wird eine solche auch noch für (den aber in mehreren anderen Indikationen geprüften) BTK-Inhibitor Remubrutinib aufgelegt.
Quellen:
1 Ann Rheum Dis 2023; 82 (Suppl 1): 94 (OP0142)
2 Ann Rheum Dis 2023; 82 (Suppl 1): 95 (OP0143)
3 Ann Rheum Dis 2023; 82 (Suppl 1): 201 (LB0003)