Ausgehend von zwei systematischen Literaturreviews wurden seitens der 33-köpfigen ASAS/EULAR-Task Force aus 16 Ländern fünf übergreifende Prinzipien definiert und nunmehr 15 spezifische Empfehlungen ausgesprochen. Von letzteren blieben acht ohne Änderung, drei wurden minimal umformuliert, je 2 erhielten ein signifikantes Update bzw. wurden gänzlich neu formuliert. Die übergreifenden Prinzipien beinhalten ohne jegliche Änderung angesichts der potenziellen Schwere der Erkrankung (1) die Forderung nach einem von einem Rheumatologen koordinierten multidisziplinären Management, (2) die Maximierung der gesundheitsbezogenen Lebensqualität durch die Kontrolle von Symptomen und Entzündung sowie Prävention progressiver struktureller Schäden, Erhalt/Normalisierung der Funktion und sozialen Teilhabe, (3) die Kombination nicht-pharmakologischer und pharmakologischer Behandlungsansätze zur Optimierung der Therapie, die (4) auf einer „shared decision“ von Arzt und Patient beruhen sollte und zudem (5) die Berücksichtigung individueller, medizinischer und gesellschaftlicher Kosten beim Therapiemanagement.
Die spezifischen Empfehlungen im Überblick
Fast unverändert blieb Empfehlung (1): Die Behandlung von axSpA-Patienten sollte individualisiert anhand der aktuellen Zeichen und Symptome der Erkrankung (axial, peripher, EAM) und Patientencharakteristika inklusive Komorbiditäten und psychosozialen Faktoren festgelegt werden. Die Krankheitskontrolle sollte (2) PROs, klinische Befunde, Laborwerte und die Bildgebung beinhalten und deren Häufigkeit individuell in Abhängigkeit von Symptomen, Schweregrad und Therapie festgelegt werden. Ebenfalls unverändert blieb Empfehlung (3), wonach sich die Therapie an einem definierten Behandlungsziel orientieren sollte.
Fast identisch blieben die Empfehlungen (4): Die Patienten sollten über ihre Erkrankung aufgeklärt und zu regelmäßiger körperlicher Aktivität sowie einem Rauchstopp ermuntert werden; zu erwägen ist eine physikalische Therapie und (5): Als First-line-Therapie bei Patienten mit Schmerzen und Steifigkeit werden unter Berücksichtigung des Nutzen und Risikos unverändert NSAR bis hin zur maximalen Dosis empfohlen, die bei gutem Ansprechen vorzugsweise kontinuierlich eingenommen werden sollten.
Unverändert blieben die nächsten drei Empfehlungen. So können (6) Analgetika wie Paracetamol oder Opiode bei Restschmerzen nach Versagen auf, Kontraindikation gegen oder schlechter Verträglichkeit empfohlener Therapien erwogen werden. (7) Lokale Glukokortikoid (GK)-Injektionen an der entzündeten Stelle können in Betracht gezogen werden, bei axialer Erkrankung sollten systemische GK nicht als Langzeittherapie gegeben werden. (8) Nach wie vor gilt, dass Patienten mit rein axialer Erkrankung für gewöhnlich nicht mit csDMARDs behandelt werden sollten, im Fall einer peripheren Arthritis kann Sulfasalazin (SSZ) erwogen werden.
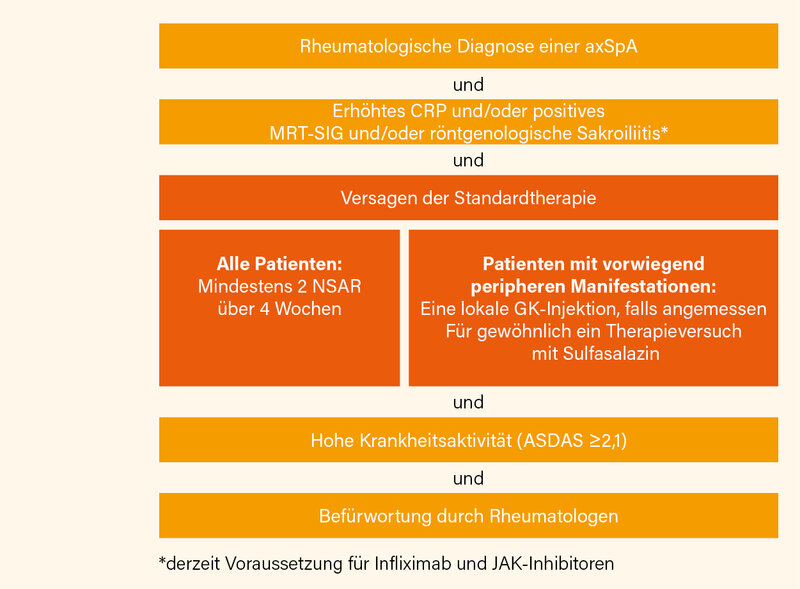
Für den Einsatz von bDMARDs bzw. tsDMARDs sollten folgende Bedingungen erfüllt sein (Abb. 1): Eine axSpA-Diagnose durch einen Rheumatologen plus erhöhtes CRP und/oder positives MRT und/oder röntgenologische Sakroiliitis plus Versagen auf zwei NSAR über 4 Wochen (bzw. bei primär peripherer Manifestation nach einer lokalen GK-Injektion bzw. Therapieversuch mit SSZ) plus hohe Krankheitsaktivität (ASDAS ≥2,1) plus eine „positive opinion“ eines Rheumatologen. Eine fortgesetzte Gabe des b/tsDMARDs sollte erwogen werden, wenn nach ≥12 Wochen eine Verbesserung im ASDAS ≥1,1 erreicht wurde und der behandelnde Rheumatologe dies befürwortet.
Noch leichte Präferenz von TNF/IL-17- gegenüber JAK-Inhibitoren
Ein signifikantes Update erfuhr Empfehlung (9): Bei Patienten mit persistierend hoher Krankheitsaktivität trotz konventioneller Therapie sollten TNFα-Inhibitoren, IL-17A-Inhibitoren oder JAK-Inhibitoren erwogen werden; derzeitige Praxis ist der Beginn mit einem TNFα- oder IL-17A-Inhibitor. Somit wurden die beiden bDMARDs-Substanzklassen einander gleichgestellt, fast auf derselben Stufe stehen die JAK-Inhibitoren, die aber (noch) nicht für die nr-axSpA zugelassen sind.
Gänzlich neu ist Empfehlung (10): Bei Patienten mit einer Vorgeschichte von rezidivierender Uveitis oder einer aktiven chronisch-entzündlichen Darmerkrankung (CED) sollten monoklonale Antikörper gegen TNFα präferiert werden, bei solchen mit signifikanter Psoriasis hingegen ein IL-17A-Inhibitor.
Ebenfalls neu ist Empfehlung (11): Das Fehlen eines Therapieansprechens sollte eine Re-Evaluation der Diagnose und die Berücksichtigung vorliegender Komorbiditäten auslösen. Signifikant neu formuliert wurde Empfehlung (12): Im Fall des Versagens einer ersten b/tsDMARD-Therapie sollte der Wechsel auf ein anderes bDMARD (TNFα- oder IL-17A-Inhibitor) oder einen JAK-Inhibitor erwogen werden.
Unverändert blieben die drei letzten Empfehlungen: (13) Ist ein Patient in anhaltender Remission, kann ein „Tapering“ (aber nicht Stoppen) eines bDMARDs in Erwägung gezogen werden. In Ermangelung entsprechender Daten wurde noch keine diesbezügliche Empfehlung für tsDMARDs ausgesprochen. (14) Eine Hüft-TEP sollte bei Patienten mit refraktären Schmerzen, Behinderung und Nachweis struktureller Schäden im Röntgen unabhängig vom Alter erwogen werden; bei schweren behindernden Deformierungen auch (in spezialisierten Zentren) eine Korrekturosteotomie. (15) Im Fall einer signifikanten Änderung des Krankheitsverlaufs sollten unbedingt auch Ursachen jenseits der Entzündung, z. B. Frakturen an der Wirbelsäule, erwogen und (einschließlich Bildgebung) evaluiert werden.
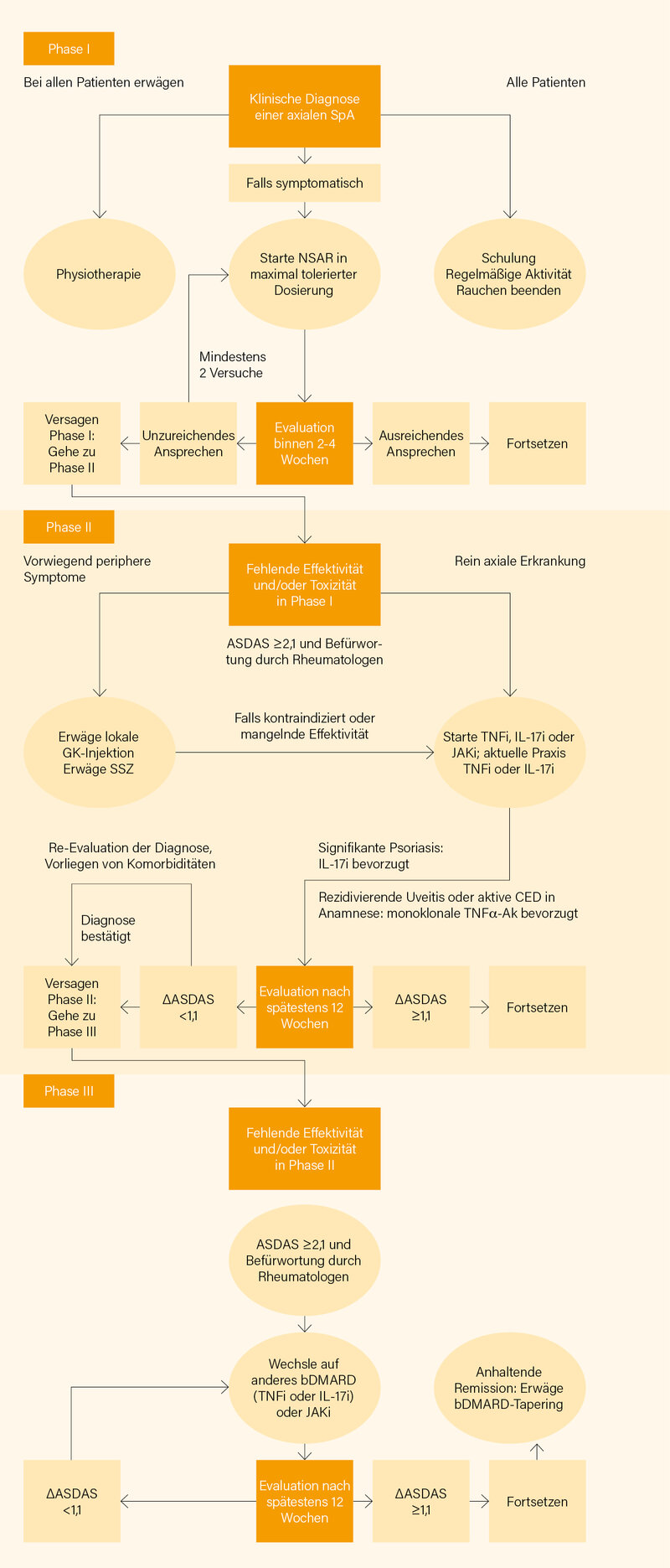
Einen guten Überblick zum praktischen Vorgehen bietet der leicht überarbeitete Therapiealgorithmus (Abb. 2).
Quelle: EULAR Recommendations Session, 1. Juni 2022