Iscalimab mit vielversprechenden Ergebnissen
Zunächst zu den 24-Wochen-Daten der noch andauernden Phase-IIb-Dosisfindungsstudie zu dem gegen CD40 gerichteten monoklonalen Antikörper Iscalimab, in der dieser in zwei distinkten Patientenpopulationen mit moderater/schwerer systemischer Krankheitaktivität (Kohorte 1) und niedriger systemischer Aktivität, aber hoher Krankheitslast (Kohorte 2) bei insgesamt 273 Patienten geprüft wurde.
In Kohorte 1 wurden 173 die 2016er ACR/EULAR-Klassifikationskriterien erfüllende Patienten (stimulierter Speichelfluss ≥0,1 ml/min., Anti-Ro/SSA-positiv) im Verhältnis 1:1:1:1 auf Iscalimab 150 mg, 300 mg bzw. 600 mg s.c. alle 2 Wochen (Q2W) oder Placebo randomisiert, in Kohorte 2 100 1:1 auf die 600 mg-Dosis oder Placebo. Die Patienten in Kohorte 1 mussten einen EULAR Sjögren’s Syndrome (SS) Disease Activity Index (ESSDAI) ≥5 und EULAR SS Patient Reported Index (ESSPRI) ≥5 aufweisen, jene in Kohorte 2 einen ESSDAI <5 mit Aktivität in biologischer Domäre ( >0) und ESSPRI (Fatigue oder Trockenheit ≥5, Impact Of Dry Eye On Everyday Life [IDEEL] ≥30). Primärer Endpunkt war der ΔESSDAI (Kohorte 1) und ΔESSPRI (Kohorte 2) bis Woche 24.
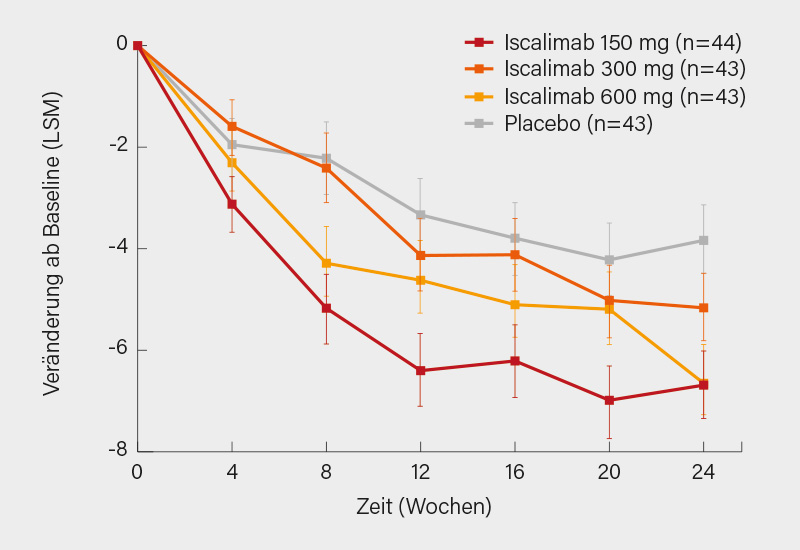
Die Baseline-Charakteristika waren vergleichbar mit Ausnahme von Kohorte 1, in der mehr Patienten auf Iscalimab 300 mg schwer aktiv waren (ESSDAI >13; 44 %) und im Vergleich zu den anderen Armen häufiger Hydroxychloroquin (HCQ, 70 %) einnahmen (ESSDAI >13, 19-28 % und HCQ 47-64 %). In Kohorte 1 zeigten sich im ΔESSDAI von Baseline bis Woche 24 signifikante Verbesserungen für die 150 mg- und 600 mg- (Δ-3,0 bzw. -2,9; je p<0,005) und ein positiver Trend für die 300 mg-Dosis (Δ -1,4; p= 0,16) (Abb.). Das primäre Ziel einer signifikanten Dosis-Response im ΔESSDAI von Baseline bis Woche 24 wurde erreicht (p=0,004) mit einem Wirkplateau bei ≥150 mg. ESSPRI, FACIT-Fatigue, Tränen- und Speichelfluss zeigten sich jeweils numerisch verbessert.
In Kohorte 2 wurde beim primären Kriterium des ΔESSPRI von Baseline bis Woche 24 ein stark positiver Trend verzeichnet (Δ -0,57; p= 0,12) mit der Verbesserung von Trockenheit (Δ -1,0; p=0,016) und Fatigue (Δ -0,8; p=0,067) als wesentlichen Treibern. Es wurde ein signifikanter Anstieg des Speichelflusses gezeigt. Bis Woche 24 traten unter Iscalimab bei 2,3-9,1 % der Patienten schwere unerwünschte Ereignisse (SAE) auf, unter Placebo bei 2-4 %. Das Infektionsrisiko war unter Iscalimab nur minimal erhöht.
Somit bewirkte der Anti-CD40-Antikörper bei guter Verträglichkeit in beiden SjS-Populationen eine klinisch bedeutsame Verbesserung, eine weitere Prüfung der (vermutlich) 150 mg-Dosis wäre angesichts des Fehlens zugelassener systemischer Therapien wünschenswert. (1)
Dazodalibep mit fortgesetzt guter Wirksamkeit
Dass der Ansatz an CD40 (hier jetzt am Liganden und mit einem Fusionsprotein) prinzipiell beim SjS funktioniert, unterstreichen die vollständigen Crossover-Daten eine Phase-II-Studie mit Dazodalibep – wieder in zwei separaten Kohorten. Bereits auf dem EULAR war gezeigt worden, dass in der Kohorte mit mäßiger bis schwerer Krankheitsaktivität (ESSDAI ≥5) der primäre Endpunkt (ΔESSDAI bis Tag 169) signifikant erreicht wurde. In der Crossover-Studie wurden 74 diese Kriterien erfüllende SjS-Patienten im Verhältnis 1:1 auf i.v. Dazodalibep 1.500 mg (n=36) oder Placebo (n=38), erst Q2W 3 Dosen, dann Q4W 4 zusätzliche Dosen, randomisiert (Phase 1). Ab Tag 169 wechselten die Dazodalibep-Patienten auf Placebo und jene von Placebo auf Dazodalibep – jeweils 5 Dosen Q4W – und wurden über 12 Wochen weiterbeobachtet (Phase 2), 95,9 respektive 90,9 % der Teilnehmer schlossen Phase 1 bzw. 2 ab.
In der Placebo/Dazodalibep-Gruppe (n=37) verbesserte sich der ΔESSDAI von Baseline von im Mittel -4,1 an Tag 169 auf -6,3 an Tag 365 in Phase 2. Im Dazodalibep/Placebo-Arm (n=34) betrug die Veränderung im ESSDAI −6,3 an Tag 169 und -4,4 an Tag 365. Die Anteile von Patienten mit ESSDAI-Ansprechen (3 oder 4 Punkte-Verbesserung ab Baseline) an Tag 365 waren größer im Placebo/Dazodalibep- als Dazodalibep/Placebo-Arm (ESSDAI [3]: 66,7 vs. 55,9 %; ESSDAI [4]: 66,7 vs. 52,9 %). In Phase 2 zeigte überdies die Placebo/Dazodalibep-Gruppe größere Verbesserungen im ESSPRI, FACIT-Fatigue und Ocular Surface Disease Index (OSDI) relativ zum Dazodalibep/Placebo-Arm. Bei ca. 75 % der Patienten kam es zu AE, die aber überwiegend mild/moderat waren (nur vier SAE). (2)
Völlig identisch war der Aufbau des zweiten Studienteils, nur dass in diese Kohorte SjS-Patienten mit inakzeptabel hoher Krankheitslast, aber einer nur limitierten extraglandulären Organbeteiligung eingingen (ESSPRI ≥5, ESSDAI <5). Auch in dieser Population war der primäre Endpunkt an Tag 169, hier der ΔESSPRI, signifikant erreicht worden. Von den 109 auf Dazodalibep (n=54) oder Placebo (n=55) randomisierten Teilnehmern schlossen 93,6 bzw. 86,2 % Phase 1 respektive 2 ab.
In der Placebo/Dazodalibep-Gruppe verbesserte sich der ΔESSPRI von Baseline von -0,5 an Tag 169 auf -1,3 an Tag 365. Vice versa blieb im Dazodalibep/Placebo-Arm der ΔESSPRI ab Baseline während Phase 1 (Tag 169) auch in der Crossover-Phase bis Tag 365 erhalten (-1,8 bzw. -1,9). Im Placebo/Dazodalibep-Arm betrug der Anteil von Patienten mit ESSPRI-Ansprechen (≥1 Punkt oder Verbesserung um ≥15 %) an Tag 169 32,7 % und stieg bis Tag 365 auf 50,0 % an. Im Dazodalibep/Placebo-Arm war von Tag 169 (66,7 %) bis Tag 365 (57,1 %) ein leichter Rückgang zu verzeichnen. Überdies gab es in der Placebo/Dazodalibep-Gruppe in Phase 2 Verbesserungen im FACIT-Fatigue und globalen Patientenurteil (PtGA). Bei 65 % der Patienten kam es zu AE, die überwiegend mild bis moderat waren (nur zwei SAE, 1 Abbruch).
Als Fazit kann gezogen werden, dass beide Crossover-Phasen der Phase-II-Studie zusätzliche Evidenz für die Wirksamkeit des bis dato relativ gut verträglichen Dazodalibep liefern, größere Studien bleiben aber zunächst abzuwarten – eine Phase-III-Studie soll jetzt vorangetrieben werden.. (3)
Quellen:
1 Arthritis Rheumatol 2023; 75 (Suppl 9): Abstr. 1634
2 Arthritis Rheumatol 2023; 75 (Suppl 9): Abstr. 1636
3 ACR Convergence 2023; Late Breaking-Poster L10