SGLT-2-Inhibitoren beim SLE
Neben der direkten Wirkung von Sodium-Glucose CoTransporter 2-Inhibitoren (SGLT-2i) auf den Glukosestoffwechsel (Blockierung der Glukoserückresorption im proximalen Nierentubulus) haben sich in mehreren Studien unabhängige protektive kardiovaskuläre (CV) und renale Effekte gezeigt (1), sodass SGLT-2i inzwischen auch zur Behandlung der chronischen Herz- und Niereninsuffizienz zugelassen sind (in Deutschland gilt dies für Dapagliflozin und Empagliflozin). Für SGLT-2i sind zudem weitere homöostatische Effekte auf Gefäßwiderstand, Blutdruck, Arteriosklerose, Körpergewicht, Natrium-, Harnsäure-, Lipidstoffwechsel und Akut-Phase-Reaktanten beschrieben. (1)
Von daher lag es nahe, auch beim SLE nach günstigen Effekten der SGLT-2i auf CV oder renale Outcomes zu suchen. Hierzu wurden mittels Data-Mining (Analyse großer Datenbestände) 96.511 elektronische Krankenakten einer großen US-amerikanischen SLE-Kohorte (≥2-malige ICD-Kodierung eines SLE, im Abstand von ≥2 Monaten und ≤2 Jahren) ausgewertet. (2) Patienten mit terminaler Niereninsuffizienz und bereits behandeltem Typ-2-Diabetes (T2D) wurden ausgeschlossen, ACE-Hemmer und Angiotensin-Rezeptorblocker waren erlaubt (45 % aller ausgewerteten Patienten). Nach Matching mittels Propensity-Score erfolgte ein Vergleich des Verlaufs von SLE-Patienten, die zwischen 3/2013 und 8/2021 eine erste Verordnung von SGLT-2i (n=401) oder einem Dipeptidylpeptidase-4-Inhibitor (DPP-4i) erhielten (n=895).
Die Hazard Ratio (HR) für Major Adverse Cardiac Events (MACE) war in der Gruppe aller SLE-Patienten (n=1.296) unter SGLT-2i mit 0,66 (95% KI 0,46-0,94) und für eine Progression der Niereninsuffizienz mit 0,71 (95% KI 0,52-0,98) signifikant geringer als unter DPP-4i. Für Lupusnephritis (LN)- Patienten lag die HR für MACE unter SGLT-2i bei 0,53 (95% KI 0,31-0,89) und für eine Progression der Niereninsuffizienz bei 0,80 (95% KI 0,52-1,23) gegenüber DPP-4i – letzteres war bei niedrigerer Fallzahl (n=141) nicht mehr signifikant.
KOMMENTAR: Diese Data-Mining-Studie (es handelt sich um eine reine, wenngleich komplexe Auswertung in elektronischen Krankenakten routinemäßig erfasster Behandlungsdaten, ohne dass irgendein realer Patient oder behandelnder Arzt hier einbezogen wurde) zeigt auch beim SLE günstige Effekte der SGLT-2i für kardiovaskuläre und renale Outcomes. Einschränkend muss gesagt werden, dass alle Patienten dieser Studie als Indikation für die Erstverordnung beider Antidiabetika einen T2D aufwiesen. Da aber in großen Non-SLE-Studien die kardiovaskulären und renalen Effekte auch unabhängig von T2D nachzuweisen waren, dürfte dies auch für Lupuspatienten hinsichtlich MACE gelten. Ob sich die nephroprotektiven Effekte auch auf die LN übertragen lassen, bleibt abzuwarten.
Blutspiegelbestimmung von Hydroxychloroquin?
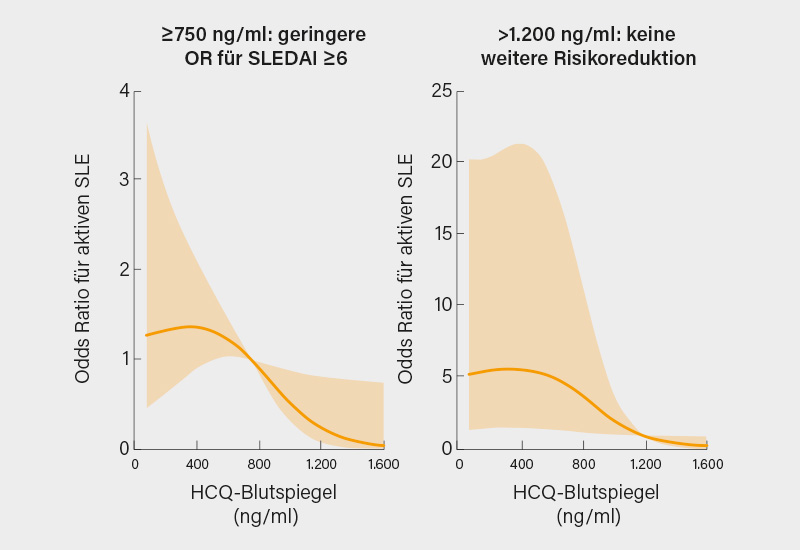
Bei vielfältigsten günstigen Effekten von Hydroxychloroquin (HCQ) beim SLE ist die optimale Dosierung nicht ganz klar. Empfehlungen der Amerikanischen Ophthalmologischen Gesellschaft (AAO) beruhen auf einem 2-fach höheren Augen-Toxizitätsrisiko bei Dosen >5 mg/kg/Tag. (3) Auf der anderen Seite gehen HCQ-Dosen <5 mg/kg/Tag mit einem ≥2-fach höheren Risiko für SLE-Schübe einher. (4) Auch wenn die Spiegelbestimmung von HCQ im Blut nicht routinemäßig verfügbar ist, soll hier eine interessante Untersuchung zur Korrelation von HCQ-Blutspiegeln mit der SLE-Krankheitsaktivität vorgestellt werden: In einer prospektiven Studie wurden HCQ-Blutspiegel und SLEDAI untersucht unter Berücksichtigung von Nierenfunktion, verordneter HCQ-Dosis und Einnahmezeitpunkt. (5) Untersucht wurden 158 SLE-Patienten (92 % weiblich, mittlere Alter 46 Jahre, Krankheitsdauer 4,8 Jahre), von denen 18 % eine hohe Krankheitsaktivität (=SLEDAI ≥6) aufwiesen.
Es konnte zunächst gezeigt werden, dass ab einem HCQ-Blutspiegel von 750 ng/ml das Risiko für einen SLEDAI ≥6 sinkt und dieses über einem Spiegel von 1.200 ng/ml nicht mehr weiter abfällt (Abb. 1). Der so ermittelte „therapeutische Bereich“ zwischen 750 und 1.200 ng/ml ging mit einer über 70%-igen Senkung des Risikos für eine erhöhte Krankheitsaktivität (SLEDAI ≥6) einher (Odds Ratio, OR 0,29, 95% KI 0,08-0,96; p<0,04). Das Erreichen therapeutischer Spiegel korrelierter mit der Höhe der Verordnung, ungünstige soziale Faktoren verringerten die Wahrscheinlichkeit effektiver Spiegel und eine höhergradige Niereninsuffizienz erhöhte das Risiko von Überdosierungen.
KOMMENTAR: Bei aktivem Lupus sollte man, insbesondere in den ersten Jahren der Behandlung (in denen HCQ-Langzeitschäden in normalen Dosierungen nicht zu erwarten sind), mit Dosisanpassungen unter 5 mg/kg/Tag eher zurückhaltend sein. So lange HCQ-Spiegelbestimmungen nicht zur Verfügung stehen, wird man weitere Erkenntnisse aus dieser Studie noch nicht in die tägliche Praxis umsetzen können.
Risiko eines kongenitalen AV-Blocks bei SS-A-(Ro)-Antikörpern
Der autoimmun bedingte, kongenitale AV-Block (cAVB) entsteht durch passiven diaplazentaren Übergang von mütterlichen Ro-/SS-A-Autoantikörpern, die eine pathogene Wirkung auf das in Entwicklung befindliche fetale kardiale Reizleitungssystem haben. (6-8) Antikörper (Ak) gegen Ro-/SS-A-Antigene werden in den meisten Seren von Müttern identifiziert, deren Neugeborene einen cAVB aufweisen und das oft, ohne dass die Frauen hiervon wissen, da keine oder noch keine klinischen Symptome von hiermit assoziierten Erkrankungen (SLE, Sjögren-Syndrom) aufgetreten sind. (7)
Die cAVB-Inzidenz liegt bei Schwangerschaften Ro-/SS-A-Ak-positiver Frauen, die in ihrer Vorgeschichte bereits eine Schwangerschaft mit cAVB hatten, bei ca. 20 % (9), ohne vorherigen AVB und damit bei jeder ersten Schwangerschaft beträgt dieses Risiko nur 1-2 %. (10) Somit wäre es hilfreich, wenn man schon für eine erste Schwangerschaft SS-A-Ak-positiver Frauen Faktoren identifizieren könnte, welche das cAVB-Risiko abschätzen helfen, zumal dieses durch die Einnahme von HCQ während der Schwangerschaft um bis zu 50 % gesenkt werden kann. (11)
Zur Frage, ob die Konzentration von SS-A/Ro-Antikörpern aufgrund ihrer pathophysiologischen Wirkung eine Bedeutung für die Entwicklung eines cAVB haben, erfolgte eine große, prospektive US-weite Studie von Schwangeren mit bekannten SS-A-Antikörpern. (12) Insgesamt 413 Schwangere wurden anhand der Konzentration ihrer Anti-SS-A/Ro-Antikörper (< oder >1.000 U/ml) aufgeteilt. Die Gruppe mit niedriger Antikörperkonzentration (n=152) wurde in der Schwangerschaft „standardmäßig“ betreut (wöchentlich oder 2-wöchentlich oder auch gar kein „Monitoring“). Die Schwangeren mit hohen SS-A-Ak-Titern (n=261) führten mit einem handlichen Gerät zu Hause selbst zwischen der 18. und 26. Schwangerschaftswoche (SSW) bis zu 3x täglich eine Messung der fetalen Herzfrequenz (FHRM – Fetal Heart Rate Monitoring) durch und übermittelten diese an das (regionale) Studienzentrum zur Auswertung von einem Kinderkardiologen. Im Falle von Auffälligkeiten wurde dies direkt mittels fetaler Echokardiografie in der Klinik kontrolliert, die ansonsten auch fest in wöchentlichem oder 2-wöchentlichem Abstand erfolgte.
Im Verlauf der Schwangerschaften kam es bei 10/413 Frauen (2,4 %) zu einem cAVB, bei 3 von 31 (10 %) auch schon nach einem cAVB in einer vorherigen Schwangerschaft. Alle (!) cAVB ereigneten sich in der Gruppe der Schwangeren mit hoch-titrigen Anti-SS-A-Antikörpern, die bei Vorgeschichte eines cAVB in 10 bis über 20 % der Fälle erneut einen cAVB entwickelten. Das Risiko für einen cAVB war in dieser Studie somit abhängig von der Konzentration der SS-A/Ro-Antikörper, wobei dies nicht für den isolierten Ro52kD-Antikörper galt: Alle Patientinnen mit cAVB wiesen Ro60-Antikörper auf, davon 9 gleichzeitig auch einen Ro52-Antikörper.
Obwohl nicht klar ist, ob und wie man darauf therapeutisch reagieren sollte, ist die Heimüberwachung (FHRM) der kindlichen Herzfrequenz offenbar eine einfache und verlässliche Methode, einen cAVB zu erkennen: 240 Schwangere haben zwischen der 17. und 26. SSW insgesamt 30.920 Messungen aufgezeichnet und an das Studienzentrum übermittelt. 45 (0,01 %) wurden vom pädiatrischen Kardiologen als pathologisch eingestuft und mittels fetalem „Notfall-Echo“ innerhalb von 12 Stunden kontrolliert. Dabei fanden sich 18 Normalbefunde, 17 vorzeitige Vorhofkontrakturen als Ursache der auffälligen Heimmessung und alle der 10 cAVB (7 II°, 3 III°). Wenn die FHRM normal war, wurde im fetalen Routineecho auch kein cAVB festgestellt.
KOMMENTAR: Diese Studie legt nahe, dass man durch Bestimmung der SS-A-Antikörperkonzentration (die bislang nur eingeschränkt verfügbar ist) eine Risikostratifizierung vornehmen kann. Bei keiner der insgesamt 413 Schwangeren mit einer Konzentration <1.000 U/ml war es zu einem cAVB gekommen und alle, die einen solchen entwickelten, wiesen deutlich höhere Werte auf (3.000 bis 100.000 U/ml). Hohe Anti-SS-A/Ro60-Ak sind zwar notwendig, aber nicht ausreichend für einen cAVB: 4 von 15 Frauen mit 2 Schwangerschaften und einem früheren cAVB hatten aktuell einen unauffälligen Schwangerschaftsausgang bei vergleichbaren Antikörpertitern in beiden Schwangerschaften und die Kinder von über 90 % der Frauen mit hohen SS-A/Ro-Ak entwickelten keinen cAVB. Dennoch könnte man aus diesen Ergebnissen ableiten, dass man Schwangeren mit niedrigen Titern von SS-A-Antikörpern nicht zu einer prophylaktischen Therapie mit HCQ raten muss. Die Eigenkontrolle der fetalen Herzfrequenz zwischen der 18. und 26. SSW scheint eine einfache und verlässliche Methode zu sein, um einen cAVB zu erkennen. Alle cAVB wiesen Auffälligkeiten bei der Selbstmessung auf und die Falsch-Positiv-Rate war unter 0,12 % aller Messungen. Allein die Konsequenz ist noch unklar: die Gabe von halogenierten (plazentagängigen) Glukokortikoiden (GK), ggfls. ergänzt um i.v. Immunglobuline, konnte bislang keine gute Evidenz für einen Effekt zeigen. Die Erkennung eines cAVB ist aber allein schon zur weiteren fetalen kardialen Überwachung (Hydrops, DCM) bedeutsam und zur Vorbereitung auf die Geburt und einer frühen Schrittmacherversorgung des Neugeborenen.
Neue Therapien für den SLE
Anifrolumab
Noch kann die Therapie mit dem IFN-a-Rezeptor-Antikörper Anifrolumab als neue Therapie für den SLE bezeichnet werden, zumal dessen Einordnung in die Stufentherapie noch im Gange ist. Es wurden jetzt auf dem ACR-Meeting wieder Daten der weiter verblindeten und placebokontrollierten Verlängerungsstudie (LTE) der beiden TULIP-Zulassungsstudien vorgestellt. (13) Von ursprünglich 662 Patienten gingen 547 in die LTE-Phase über, von denen inzwischen 536 (98 %) die vorgesehene 3-jährige Nachbehandlung abgeschlossen haben. Verbesserungen in den einzelnen SLEDAI 2K-Organdomänen von Woche 0 zu Woche 208 bestätigten die gute Wirkung auf die Haut (80 vs. 59 % unter Placebo) und offensichtlich auch Gelenke und Muskeln (72 vs. 56 %). Auch einzelne Immunparameter besserten sich unter Anifrolumab deutlicher als unter Placebo (32 vs. 15 %). Die Wirksamkeit auf hämatologische und renale Manifestationen kann anhand dieser LTE-Daten aufgrund der dafür zu geringen Fallzahl noch nicht beurteilt werden – eine aktive LN war bei den TULIP-Studien auch ausgeschlossen.
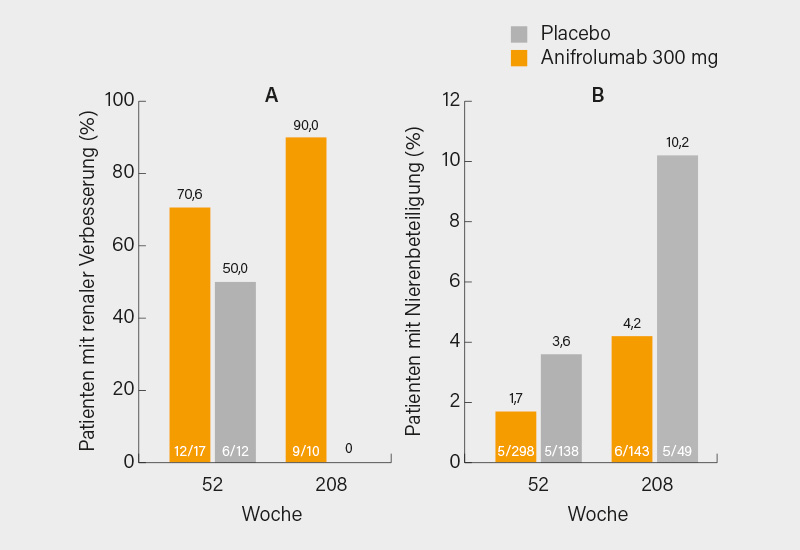
Zu der naheliegenden Frage, ob Anifrolumab vielleicht (ähnlich wie Belimumab) auch bei der LN einen zusätzlichen Effekt haben könnte, wurde dennoch eine Analyse der TULIP-Studien vorgestellt. (14) Da nur eine aktive LN ausgeschlossen war, die u. a. an einer Eiweißausscheidung >2 g/g Kreatinin und einer Erythrozyturie festgemacht wurde, gab es in beiden TULIP-Studien durchaus Patienten, die keine Hinweise für eine aktive LN boten, aber eine geringe Eiweißausscheidung (UPCR >0,5 bis <2,0) aufwiesen. Dies waren 24/358 Patienten unter Anifrolumab (6,7 %) und 15/178 unter Placebo (8,4 %). Von diesen wiesen im Verlauf der LTE-Studie von (weiteren) 3 Jahren unter Anifrolumab deutlich mehr eine Verbesserung renaler SLEDAI-Parameter (z. B. Hämaturie, Proteinurie) auf als unter Placebo (jeweils zusätzlich zu einer Standardtherapie) (Abb. 2a). Wichtiger scheint der Unterschied im Hinblick auf die Entwicklung einer Nierenbeteiligung unter Anifrolumab gegenüber Placebo zu sein (Abb. 2b). Obwohl dies relativ selten der Fall war, zeigten sich auch hier leicht bessere Ergebnisse unter Anifrolumab als unter Placebo.
KOMMENTAR: Dies könnten erste Hinweise darauf sein, dass auch Anifrolumab einen gewissen Effekt bei der LN hat. Diese Frage wird aber erst die bereits laufende Phase-III-Studie IRIS zu dessen Einsatz bei der LN beantworten.
Voclosporin
Der neue Calcineurininhibitor Voclosporin ist zwar zugelassen, es könnte aber sein, dass die Substanz aufgrund gescheiterter Preisverhandlungen in Deutschland nicht mehr verfügbar ist. Dies wäre insofern von Tragweite, als Voclosporin vor allem bei sog. „großer“ Proteinurie einen deutlichen und vor allem raschen Effekt aufwies, von dem noch nicht klar ist, inwieweit dieser sich auch auf den Langzeit-Outcome auswirkt. Der hierfür bislang beste bekannte Prognosefaktor ist das Absenken einer Proteinurie auf ein Protein/Kreatinin-Verhältnis im Urin (UPCR) von ≤0,7 innerhalb von 6-12 Monaten. Gegenüber einem Nicht-Erreichen dieses Zieles ist dies signifikant mit dem Vermeiden einer terminalen Niereninsuffizienz assoziiert. (15, 16)
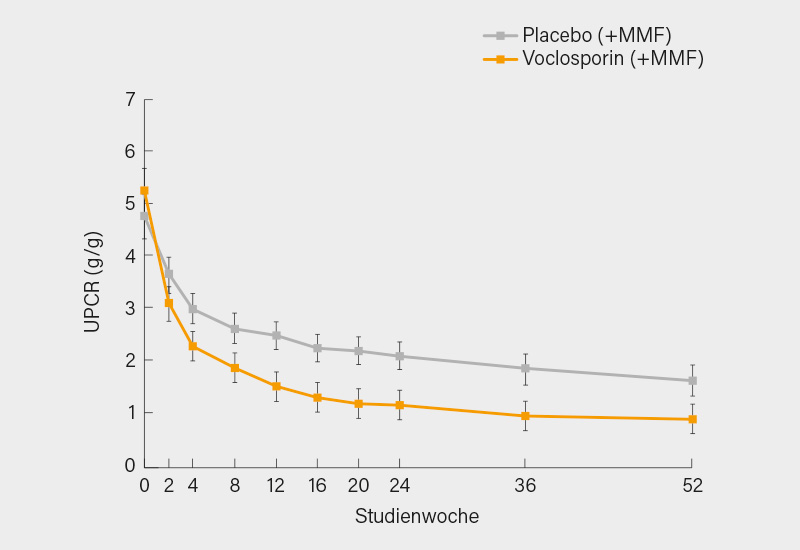
Eine Post-hoc-Analyse der Patienten mit „großer“ Proteinurie (UPCR ≥2) aus den Voclosporin-Studien wurde jetzt auf dem ACR vorgestellt. (17) 217/268 Patienten der Voclosporin- und 215/266 Patienten der Kontrollgruppe wiesen zu Beginn der AURORA-Studie (Voclosporin bei LN) eine UPCR ≥2 (5,2 vs. 4,6) auf. Der Rückgang der UPCR nach 52 Wochen gegenüber dem Ausgangswert war -3,8 unter Voclosporin + Mycophenolat Mofetil (MMF) gegenüber -3,1 unter Placebo + MMF (p=0,0003). Der Unterschied von 0,7 Punkten in der UPCR mag auf den ersten Blick gering erscheinen, macht aber immerhin 15 % vom mittleren Ausgangswert aus und wurde zudem deutlich eher erreicht: eine durchschnittliche UPCR von 2,0 wurde unter Voclosporin schon in Woche 8 verzeichnet, unter Placebo erst in Woche 36 (Abb. 3). Offen bleibt nur die Frage, ob der Voclosporin-Effekt auf die Podozyten (erster, rascher Rückgang der Proteinurie) genauso prognostisch bedeutsam ist, wie der einer antiinflammatorischen Therapie der LN mit MMF.
Weitere Therapieformen am Horizont
Es gab noch Berichte zum BLyS-Rezeptor-Inhibitor Ianalumab (18), über den an dieser Stelle schon vom EULAR-Meeting 2023 berichtet wurde. Dann zum B-Zell-Antikörper Obinutuzumab (19), über den schon seit 2020 mehrfach berichtet wurde und zu dem Tyrosinkinase (TYK)-2-Inhibitor Deucravacitinib (20), über den hier 2022 berichtet wurde. Bei allen diesen Substanzen handelt es sich aber nicht um grundsätzlich neue Therapieprinzipien und es müssen die Ergebnisse laufender Phase-III-Studien abgewartet werden, die im Falle von Obinutuzumab Ende 2024 zu erwarten sind.
Ein interessantes neues Therapieprinzip ist dagegen die Hemmung von Toll-like-Rezeptoren beim SLE mit dem small molecule Afimetoran, das in einer Phase-I-Studie untersucht wurde und bei guter Verträglichkeit einen deutlichen Effekt auf die Haut zeigte. (21) Hierzu läuft gerade eine Phase-II-Studie an.
CAR-T-Zell-Therapie bei SLE
Seit dem EULAR-Meeting 2022 finden die Beiträge der Erlanger Arbeitsgruppe um Georg Schett zum Einsatz von Chimären CD19-Antigenrezeptor-T (CAR-T)-Zellen zur Therapie des SLE große Beachtung. Auf dem ACR 2023 stand deren Einsatz beim SLE und anderen Kollagenosen im Zentrum des Interesses und inzwischen legten auch andere Arbeitsgruppen erste Erfahrungen mit der CAR-T-Zell-Therapie vor.
Jule Taubmann aus Erlangen berichtete über 15 mittels CAR-T-Zell-Therapie behandelte Patienten mit SLE (n=8, 7 weiblich, im Mittel 27 Jahre), autoimmunen Myositiden (n=3, 2 weiblich, im Mittel 42 Jahre) und systemischer Sklerose (n=4, 1 weiblich, im Mittel 45 Jahre). (22) Nach T-Zell-Apherese, Aufreinigung, Virus-Transfektion mit dem CD19-Rezeptor, Expansion und Reinfusion der modifizierten CAR-T-Zellen nach Konditionierung mit Fludarabin und Cyclophosphamid expandieren diese in vivo bis etwa um den Tag 9 nach Infusion, um dann über ca. 2-3 Monate bis zur Nachweisgrenze abzufallen. Nach rascher B-Zell-Depletion innerhalb weniger Tage kommt es innerhalb von 50 bis 150 Tagen nach der CAR-T-Zell-Therapie zur B-Zell-Rekonstitution.
Die Patienten blieben für durchschnittlich 15,6 Monate progressionsfrei, 100 % befinden sich in Vollremission. Die in der Hämatologie bekannte therapieassoziierte Morbidität in Form eines Cytokine-Release-Syndroms (CRS) und eines Immunzell-assoziiertes Neurotoxizitätssyndrom (ICANS) war bei den Autoimmunerkrankungen mit 66 % bzw. 6 % relativ seltener und vor allem in der Schwere geringer ausgeprägt. Im Verlauf der weiteren Monate kam es neben Infekten der oberen Luftwege und Harnwegsinfekten an schwereren Infekten bei den 15 Patienten nur zu einer Pneumonie und einer Zoster-Infektion. Bei deutlichem und anhaltendem Rückgang der Auto-Ak (bis unter die Nachweisgrenze) wurden die Impftiter durch die CAR-T-Zell-Therapie nur moderat abgesenkt, was auf eine Persistenz langlebiger Plasmazellen hinweist.
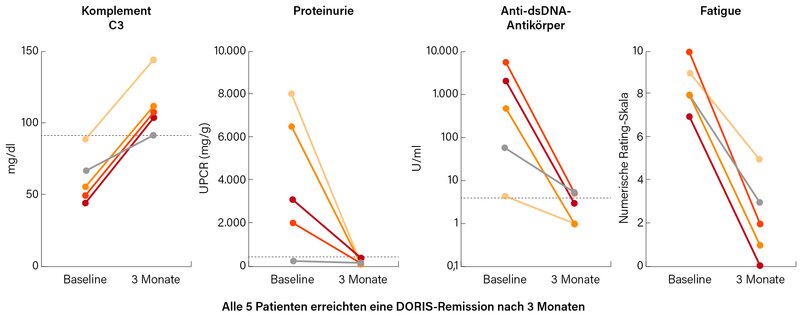
Georg Schett stellte in einem weiteren Vortrag Wirksamkeitsdaten der CAR-T-Zell-Therapie bei den 8 SLE-Patienten vor. (23) Bei allen kam es zu einem Abfall der dsDNA-Ak, Anstieg der Komplementfaktoren und deutlichem Rückgang der Proteinurie. Auch die Fatigue der ersten 5 SLE-Patienten ging deutlich zurück (Abb. 4). Im Follow-Up von 1-2 Jahren blieben die Auto-Ak (dsDNA, ssRNA, NUC, SNEC, sm, Ro60) der 8 SLE-Patienten vollständig negativ, während die Impftiter (Masern, Mumps, Röteln, Tetanus, VZV, EBV, Pneumokokken) weitgehend erhalten blieben.
Neben den 3 Patienten mit autoimmunen Myositiden (24) und den 3 ersten mit systemischer Sklerose (25) aus Erlangen berichtete auch eine Arbeitsgruppe aus Barcelona (26) über ihre ersten Erfahrungen mit der CD19-CAR-T-Zell-Therapie Es wird auch an CAR-T-Zellen geforscht, die gegen weitere Antigene (BCMA in Kombination mit CD19 oder gegen anti-OX40L) gerichtet sind. (27, 28)
KOMMENTAR: Die Ergebnisse der CAR-T-Zell-Therapie sind schon beeindruckend und aufgrund der dabei gegenüber einer Stammzelltherapie nicht mehr notwendigen myeloablativen Gabe von Alkylantien bietet diese eine geringere therapieassoziierte Belastung der Patienten. Dennoch wird man weitere Daten zum Langzeitverlauf derart aufwändig therapierter Patienten abwarten müssen – sowohl im Hinblick auf Wirksamkeit wie auch zur Sicherheit.
Neue Klassifikationskriterien für das Antiphospholipidsyndrom
In einer eigenen Session wurden die kürzlich publizierten (29) neuen ACR/EULAR- Klassifikationskriterien für das Antiphospholipidsyndrom (APS) vorgestellt. (30) Auch wenn hierüber schon vor einem Jahr berichtet wurde, sollen insbesondere nochmal die Änderungen gegenüber den Sidney-Kriterien von 2006 (31) dargestellt werden.
Die neuen Kriterien sehen als Eingangsbedingungen das Vorliegen mindestens eines Kriteriums (aus den klinischen Domänen 1-6, Tab. 1a) und eines positiven Antiphospholipid (aPL)-Labortests vor (Lupusantikoagulans oder eindeutig erhöhte IgG- oder IgM-Titer für Anti-Cardiolipin [aCL] und Anti-b2-Glykoprotein I [ab2GPI]) vor sowie einen max. Abstand von 3 Jahren zwischen klinischem und serologischem Kriterium (Tab. 1b). Wichtig ist, dass ein Kriterium nur dann zu werten ist, wenn es keine gleich gute oder bessere Erklärung hierfür gibt als ein anzunehmendes APS. Innerhalb der klinischen und der serologischen Domänen wird jeweils nur der höchste Wert für den Gesamtscore herangezogen. Eine Klassifikation als APS kann erfolgen, wenn jeweils ≥3 Punkte in den klinischen und den serologischen Domänen erreicht werden.
Änderungen durch die neuen APS-Klassifikationskriterien 2023
Die auffälligste Änderung ist die Wichtung sämtlicher klinischer und serologischer Kriterien nach Punkten. Bei den klinischen Manifestationen erfolgt nun eine Risikostratifizierung makrovaskulärer Ereignisse (Thrombembolien) nach der Frage, ob es zusätzliche Risikofaktoren bei einem thrombembolischen Ereignis gab oder nicht. Auch wenn beim APS oft zusätzliche Risikofaktoren für Thrombosen, wie z. B. eine Immobilisation, zu einem klinischen Ereignis führen, ist das Auftreten einer unprovozierten Thrombose, also einer solchen ohne begleitende Risikofaktoren, ein stärker zu wichtendes klinisches Kriterium gegenüber einer Thrombose z. B. im Rahmen eines operativen Eingriffes.
Auch die schon zuvor sehr genau definierten Schwangerschaftskomplikationen werden jetzt gewichtet (v. a. bei der Eklampsie). Neue klinische Kriterien sind mikrovaskulärer Manifestationen wie Gangrän oder thrombotische Mikroangiopathie (TMA), z. B. der Nieren, Herzklappenerkrankung (typisch ist die Libman-Sacks-Endokarditis) und die Thrombozytopenie, die meist nicht so ausgeprägt ist, wie die bei der Immunthrombozytopenie (20-130/nl).
Serologisch hat die prognostisch bedeutsame Wichtung der ein-, zwei- und dreifach- Positivität für Antiphospholipidantikörper (Triple-positiv: aCL+, ab2+, LA+) Eingang gefunden und der wichtige Unterschied von IgG- gegenüber IgM-Ak im Hinblick auf ihre Spezifität für das APS. Die häufig passager und falsch positiven, isolierten IgM-Antiphospholipidantikörper wurden nun entsprechend heruntergestuft. Neu ist auch die weitere Anhebung und Wichtung klinisch relevanter aCL/ab2GPI-Grenztiter: Als moderat positiv gelten Antiphospholipidantikörper >40 U/ml, als hoch positiv >80 U/ml. Das liegt weit oberhalb der von Laboren angegebenen „Normwerte“, die nicht die Risikogruppe APS richtig abgrenzen, die deutlich höhere Titer aufweist.
KOMMENTAR: Die neuen Klassifikationskriterien sind sicher komplizierter als die alten, dürften aber – bei korrekter Anwendung – deutlich besser geeignet sein, APS-Patienten zu charakterisieren.
Erfreulich ist, dass die Laboruntersuchungen nicht durch Einbeziehung zusätzlicher Seroparameter „aufgeweicht“ wurden. Mehrere weitere Antikörper konnten zwar in Untersuchungen Assoziationen zum APS oder zu Thrombembolien zeigen, aber keinen diagnostischen Zugewinn gegenüber den besser bekannten und untersuchten aPL belegen. Im Gegenteil hätte dies dazu geführt, dass durch mehr unspezifisch positive Laborergebnisse die Diagnose eines APS deutlich häufiger von Nicht-Spezialisten gestellt worden wäre. Dem wird bei den neuen Kriterien auch durch die nochmalige Anhebung der Grenzwerte für die positive Wertung der Labortests begegnet und die deutlich geringere Wichtung der weniger spezifischen IgM-aPL (1 Punkt) gegenüber den IgG-aPL (je nach Höhe 4-7 Punkte). Unverändert kann man sich in der täglichen Praxis auf die Triple-Positivität, dem gleichzeitigen Vorliegen eines Lupusantikoagulans und von eindeutig erhöhten Antikörpern gegen Cardiolipin und b2-Glykoprotein I verlassen.
Prof. Dr. med. Christof Specker
Klinik für Rheumatologie & Klinische Immunologie
Evangelisches Krankenhaus,
Pattbergstraße 1-3, 45239 Essen
Literatur: 1 Cowie MR, Fisher M. Nat Rev Cardiol 2020; 17(12):761-772 | 2 Jorge A et al., Arthritis Rheumatol 2023; 75 (Suppl 9): Abstr. 1579 | 3 Marmor MF et al., Ophthalmology 2016; 123(6): 1386-1394 | 4 Jorge AM et al., JAMA 2022; 328(14): 1458-1460 | 5 Garg S et al., Arthritis Rheumatol 2023; 75 (Suppl 9): Abstr. 0785 | 6 Buyon JP, Winchester R. Arthritis Rheum 1990; 33(5): 609-614 | 7 Llanos C et al., Rheumatology (Oxford) 2012; 51(6): 1086-1092 | 8 Brito-Zerón P et al., Nat Rev Rheumatol 2015; 11(5): 301-312 | 9 Buyon JP et al., J Am Coll Cardiol 1998; 31(7): 1658-1666 | 10 Brucato A et al., Arthritis Rheum 2001; 44(8): 1832-1835 | 11 Izmirly P et al., J Am Coll Cardiol 2020; 76(3): 292-302 | 12 Cuneo B et al., Arthritis Rheumatol 2023; 75 (Suppl 9): Abstr. 1682 | 13 Furie R et al., Arthritis Rheumatol 2023; 75 (Suppl 9): Abstr. 0597 | 14 Furie R et al., Arthritis Rheumatol 2023; 75 (Suppl 9): Abstr. 0595 | 15 Dall'Era M et al., Arthritis Rheumatol 2015; 67(5): 1305-1313 | 16 Tamirou F et al., Lupus Sci Med 2015; 2(1): e000123 | 17 Littlejohn E et al., Arthritis Rheumatol 2023; 75 (Suppl 9): Abstr. 2326 | 18 Shen N et al., Arthritis Rheumatol 2023; 75 (Suppl 9): Abstr. 2487 | 19 Rovin BH et al., Arthritis Rheumatol 2023; 75 (Suppl 9): Abstr. 0784 | 20 Furie R et al., Arthritis Rheumatol 2023; 75 (Suppl 9): Abstr. 0596 | 21 Hosein F et al., Arthritis Rheumatol 2023; 75 (Suppl 9): Abstr. L17 | 22 Taubmann J et al., Arthritis Rheumatol. 2023; 75 (Suppl 9): Abstr. 0783 | 23 Schett G et al., Arthritis Rheumatol 2023; 75 (Suppl 9): Abstr. 0607 | 24 Taubmann J et al., Arthritis Rheumatol 2023; 75 (Suppl 9): Abstr. 2463 | 25 Bergmann C et al., Arthritis Rheumatol 2023; 75 (Suppl 9): Abstr. 2598 | 26 Cortés Hernández J et al., Arthritis Rheumatol 2023; 75 (Suppl 9): Abstr. L13 | 27 Yuan Y et al., Arthritis Rheumatol 2023; 75 (Suppl 9): Abstr. 1493 | 28 Wobma H et al., Arthritis Rheumatol 2023; 75 (Suppl 9): 0799 | 29 Barbhaiya M et al., Ann Rheum Dis 2023; 82(10): 1258-1270 | 30 Erkan D et al., ACR 2023 Session 13M118 | 31 Miyakis S et al., J Thromb Haemost 2006; 4(2): 295-306