Bereits im Februar dieses Jahres waren vom Hersteller vorab erste Daten einer globalen, 12-wöchigen, randomisierten, doppelblinden, placebokontrollierten Phase-II-Studie zum Einsatz des oralen GPCR68-Inhibitors FT011 bei Patienten mit diffus-kutaner SSc (dcSSc) vermeldet worden, in San Diego gab es nun weitere Details zu dieser Studie.
GPCR68-Antagonist gibt Anlass zu Hoffnungen
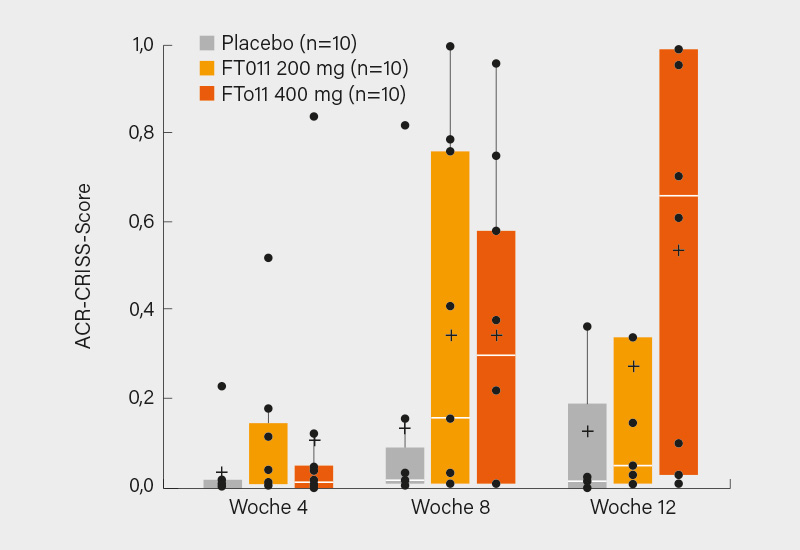
FT011 wird als antifibrotisch wirksame Substanz, die gezielt am Transforming Growth Factor beta (TGF-b) und Platelet-Derived Growth Factor (PDGF) angreift, derzeit in einer Reihe von Indikationen geprüft, jenseits der SSc etwa auch bei idiopathischer Lungenfibrose. In der nun präsentierten multizentrischen 12-Wochen-Studie mit noch andauerndem Follow-up in einer 9-monatigen Open-Label-Extension (OLE) wurden 30 erwachsene Patienten (im Mittel 51 Jahre, 73 % Frauen) mit dcSSc im Verhältnis 1:1:1 für 12 Wochen auf 1x täglich FT011 400 mg, FT011 200 mg (je 2 Kapseln) oder Placebo zusätzlich zu einer Standardtherapie (SoC) randomisiert. Die Therapie mit FT011 400 mg über 12 Wochen resultierte in signifikanten und klinisch bedeutsamen Verbesserungen im ACR Combined Response Index in dcSSc (ACR-CRISS)-Score: Zu Woche 12 wurden 60 % der Patienten im FT011 400 mg-Arm als klinische Responder mit Verbesserung im ACR-CRISS (definiert als prädizierte Wahrscheinlichkeit ≥0,60) eingestuft gegenüber 10 % im Placebo-Arm (nominal p=0,046), in der 200 mg-Gruppe waren es 20 %. Der mediane ACR-CRISS-Score betrug unter FT011 und Placebo 0,660 vs. 0,015, der mittlere ACR-CRISS-Score 0,542 vs. 0,131 (nominal p=0,019) (Abb.). Drei der Patienten aus der 400 mg-Gruppe erreichten den bestmöglichen ACR-CRISS-Score (1,0).
Signifikante klinische Verbesserungen zeigten sich für die 400 mg-Dosierung auch in der Lungenfunktion (%FVC; p=0,018), eine minimal klinisch bedeutsame Differenz (MCID) erreichten 50 vs. 0 % der (Placebo-)Patienten. Dasselbe galt für den Scleroderma Health Assessment Questionnaire-Disability Index (SHAQ-DI; p=0,019): 60 vs. 22 % erfüllten das Kriterium einer MCID. Numerische Vorteile zeigten sich in Woche 12 auch im modifizierten Rodnan Skin-Score (mRSS; (Δ -3,25 unter 400 mg vs. Δ -1,8 unter Placebo). Für die 400 mg-Dosis waren versus Placebo signifikante Verbesserungen bei Schmerz, Dyspnoe, digitalen Ulzera und der Gesamtkrankheitsaktivität ersichtlich. Gleiches gilt für das globale Arzturteil (PhGA) in Woche 12 (p=0,022). Auch die Verträglichkeit war gut, es kam nicht zu Studienabbrüchen oder ernsten Neben-
wirkungen.
Für den kurzen Beobachtungszeitraum sind die unter FT011 beobachteten Verbesserungen beachtlich, aber erst größere Studien mit längerem Follow-up werden hier valide Aussagen über das tatsächliche Potenzial dieses Wirkstoffs zulassen. Enttäuschungen nach zunächst ermutigenden Phase-II-Daten gab es bei SSc leider schon öfter. Eine Phase-III-Studie wird derzeit offenbar vorbereitet. (1)
SSc-ILD: Ähnliche Effektivität antientzündlicher Therapien
Auf Basis von SSc-ILD-Patienten aus der EUSTAR-Datenbank wurde ein (indirekter) Head-to-head-Vergleich der Immunsuppressiva (IS) mit der besten Evidenz, Tocilizumab, Rituximab, Mycophenolat Mofetil (MMF) und Cyclophosphamid (CYC), angestrebt. In die IPTW-Analyse sowie Average Treatment Effect (ATE)-Auswertung zum paarweisen Vergleich gingen 995 Patienten mit 1.050 Therapiezyklen ein, primärer Endpunkt war die Veränderung der %FVC im Verlauf des median 11-monatigen Follow-up. Patienten auf Tocilizumab hatten mehr Arthritis, eine höhere Baseline-FVC und -DLCO, mehr retikuläre Veränderungen in der HRCT und weniger Milchglastrübung, Rituximab- und CYC-Patienten hatten höhere CRP-Werte, Tocilizumab- und Rituximab-Patienten wiesen einen höheren Baseline-mRSS sowie mehr digitale Ulzera auf und waren seltener IS-naiv.
Die IPTW-Analyse zeigte im prädizierten %FVC keine signifikante Unterschiede zwischen den vier Therapien. In den Paarvergleichen war nur jener zwischen CYC und Rituximab signifikant (Δ%FVC pred. 2,29; p=0,034). In der multivariaten logistischen Regression war nur CYC mit einer stabilen oder verbesserten FVC assoziiert. Die Therapieunterschiede zwischen den Gruppen in puncto Δ%FVC pred. waren nicht signifikant in Patienten mit früheren oder zusätzlichen IS oder bei einer Therapiedauer >18 Monate. Überraschenderweise war MMF effektiver nach IS-Vorbehandlung (p=0,047). Somit zeigte diese erste große Real-World-Beobachtungsstudie bei SSc-ILD eine ähnliche Effektivität aller vier Therapien mit (obwohl signifikant) nur klinisch marginalen Vorteilen von CYC in einigen Subanalysen. (2)
Last but not least sei noch kurz eine als Late Breaking-Poster vorgestellte Analyse zu fünf Patienten mit refraktärer juvenile-onset SSc (jSSc) von Kathryn Torok, Pittsburgh (USA), und Kollegen erwähnt. Nach Versagen auf ≥3 immunmodulierende Therapien wurde in allen Fällen nach einer autologen Stammzelltransplantation (ASCT) bislang ein langfristig (über 6 Monate bis 2 Jahre) gutes Behandlungsergebnis erzielt, mit vor allem Verbesserungen der Haut (mRSS), im Gastrointestinal-Trakt und Stabilisierung der Lungenfunktion (FVC). (3)
Quellen:
1 Arthritis Rheumatol. 2023; 75 (Suppl 9): Abstr. 2593
2 Arthritis Rheumatol. 2023; 75 (Suppl 9): Abstr. 2596
3 ACR Convergence 2023; Late Breaking-Poster L06