2023 Update der EULAR Recommendations zur Behandlung der SSc
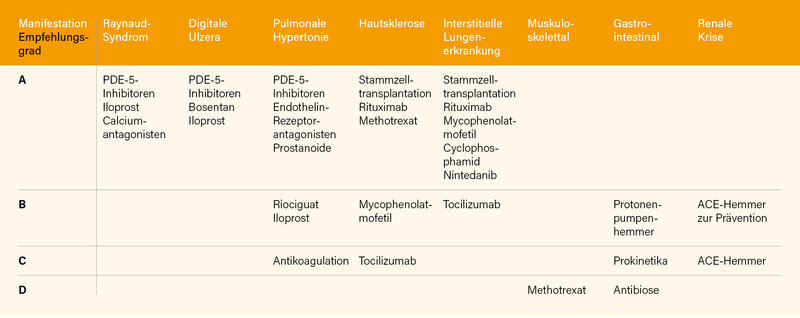
Die Empfehlungen zur Behandlung der SSc wurden von Francesco del Galdo, Leeds (Großbritannien), vorgestellt. (1) Die EULAR Task Force umfasste 38 Mitglieder aus 14 Ländern, darunter 18 Rheumatologen. Nach einem Online-Survey wurden unter Berücksichtigung der letzten Recommendations von 2017 aus 212 neuen Fragestellungen 31 zu Interventionen priorisiert und in einem Konsensus-Hybrid-Meeting abgestimmt. Die nach den unterschiedlichen Manifestationen der SSc empfohlenen Behandlungen sind in Tab. 1 wiedergegeben. Auch wenn inzwischen einzelne Substanzen evidenzbasiert empfohlen werden können, belegt die Tabelle doch eher den nach wie vor sehr hohen „medical need“ für die SSc.
2023 Update der EULAR Recommendations zum Management des SLE
Das 2023 Update der letzten EULAR-Recommendations von 2019 zum SLE Management wurden von Dimitrios Boumpas, Athen (Griechenland), vorgestellt. (2) Die EULAR Task Force bestand aus 48 Mitgliedern weltweiter Provenienz, von denen 35 Rheumatologen und 5 Nephrologen waren. Außerdem waren Patientenvertreter und Methodiker beteiligt. Die systematische Literaturrecherche identifizierte über 7.000 Publikationen, von denen 437 einer genaueren Analyse unterzogen wurden.
Overarching principles (= Standard of Care)
- Der SLE erfordert ein multidisziplinäres, individuelles Management mit Patientenaufklärung und gemeinsamer Entscheidungsfindung unter Berücksichtigung der Kosten für Patient und Gesellschaft.
- Die Krankheitsaktivität sollte bei jedem Klinikbesuch (die Häufigkeit liegt im Ermessen des Arztes) mit einer Bewertung der Organschäden (mindestens jährlich) unter Verwendung validierter Instrumente beurteilt werden.
- Nicht-pharmakologische Interventionen wie Sonnenschutz, Raucherentwöhnung, gesunde, ausgewogene Ernährung, regelmäßige Bewegung und Maßnahmen zur Förderung der Knochengesundheit sind wichtig, um die langfristigen Ergebnisse zu verbessern.
- Pharmakologische Interventionen richten sich nach Patientenmerkmalen, Art und Schwere der Organbeteiligung, behandlungsbedingten Schäden, Begleiterkrankungen, dem Risiko fortschreitender Organschäden und den Präferenzen der Patienten.
- Eine frühzeitige SLE-Diagnose (einschließlich serologischer Untersuchungen), ein regelmäßiges Screening auf Organbeteiligung (insbesondere Nephritis), ein sofortiger Behandlungsbeginn mit dem Ziel einer Remission (oder einer geringen Krankheitsaktivität, wenn dies nicht möglich ist) und eine strikte Einhaltung der Behandlung sind unerlässlich, um Schübe und Organschäden zu verhindern, die Prognose zu verbessern und die Lebensqualität zu erhöhen.
Empfehlungen
- Hydroxychloroquin: Hydroxychloroquin (HCQ) wird für alle Patienten empfohlen, es sei denn, es besteht eine Kontraindikation (Evidenzlevel 1b/Empfehlungsgrad A). Die Zieldosis liegt bei 5 mg/kg Körpergewicht/Tag (2b/B), ist jedoch nach Risiko eines Krankheitsschubs und einer Netzhauttoxizität individuell anzupassen.
- Glukokortikoide: Glukokortikoide (GK) werden, falls erforderlich, je nach Art und Schwere der Organbeteiligung dosiert (2b/C). GK sollten in der Erhaltungsdosis auf max. 5 mg/Tag (Prednisonäquivalent) reduziert und, wenn möglich, ganz abgesetzt werden (2a/B). Bei Patienten mit mittelschwerer bis schwerer Erkrankung können Pulse von i.v. Methylprednisolon (MP) (125-1.000 mg/Tag, für 1-3 Tage) in Betracht gezogen werden (3b/C).
- Immunmodulierende/immunsuppressive Therapie zur GK-Einsparung: Bei Patienten, die nicht auf HCQ (allein oder in Kombination mit GK) ansprechen oder die nicht in der Lage sind, GK unter eine für die Dauertherapie akzeptable Dosis zu reduzieren, sollte die Gabe von immunmodulierenden oder immunsuppressiven Medikamenten erwogen werden, z. B. Methotrexat (MTX) (1b/B), Azathioprin (2b/C), Mycophenolat (2a/B) und/oder Biologika, z. B. Belimumab (1a/A) oder Anifrolumab (1a/A).
- Organ- oder lebensbedrohliche Erkrankung: Bei organ- oder lebensbedrohlicher Erkrankung sollte i.v. Cyclophosphamid (CYC) (2b/C) in Betracht gezogen werden; in refraktären Fällen kann Rituximab (2b/C) in Betracht gezogen werden.
- Hautbeteiligung: Eine aktive Hautbeteiligung sollte je nach Bedarf mit topischen GK, Calcineurin-Inhibitoren (CNI) (2b/B), Antimalariamitteln (HCQ, Chloroquin – 1a/A) und/oder systemischen GK (4/C) behandelt werden. Als Zweitlinientherapien werden MTX (1b/B), Mycophenolat (4/C), Anifrolumab (1a/A) oder Belimumab (1a/B) empfohlen.
- Neuropsychiatrischer SLE: Bei aktiven SLE-bedingten neuropsychiatrischen Manifestationen (NPSLE) sollten GK und Immunsuppressiva bei entzündlichen Prozessen (1b/A) und Thrombozytenaggregationshemmung und/oder Antikoagulation für arteriosklerotische oder aPL-bezogene Manifestationen (2b/C) erwogen werden.
- Hämatologische Manifestationen: Zur akuten Behandlung einer schweren Autoimmunthrombozytopenie sollten hochdosierte GK (einschließlich i.v. MP-Pulse) (4/C) mit/ohne i.v. Immunglobuline (4/C) und/oder Rituximab (2b/B) und/oder hochdosiertes i.v. CYC (4/C) in Betracht gezogen werden, gefolgt von einer Erhaltungstherapie mit Rituximab (2b/B), Azathioprin (2b/C), Mycophenolat (2b/C) oder Cyclosporin A (CsA) (4/C). Die Behandlung einer Autoimmunhämolyse wird „in ähnlicher Weise“ empfohlen.
- Lupusnephritis – Initialtherapie: Patienten mit aktiver proliferativer Lupusnephritis (LN) sollten niedrig dosiertes (Euro Lupus-Protokoll) i.v. CYC (1a/A) oder Mycophenolat (1a/A) und GK (i.v. MP-Pulse gefolgt von niedrig dosierten oralen GK) erhalten. Eine Kombinationstherapie mit Belimumab (entweder mit CYC oder MMF [1b/A]) oder CNI (insbesondere Voclosporin oder Tacrolimus), kombiniert mit MMF [1b/A]) sollte in Betracht gezogen werden.
- Lupusnephritis – Erhaltungstherapie: Nach renaler Response sollte die Behandlung der LN für mindestens drei Jahre fortgesetzt werden (2b/B): ursprünglich mit Mycophenolat Behandelte (± Belimumab oder CNI) sollten weiter Mycophenolat erhalten (1a/A); ursprünglich mit CYC Behandelte (± Belimumab) Mycophenolat oder Azathioprin (1a/A).
- Lupusnephritis bei Patienten mit hohem Risiko für Nierenversagen: Bei hohem Risiko für ein Nierenversagen, bei (deutlich) reduzierter glomerulärer Filtrationsrate (GFR), histologischem Befund einer rapid progressiven Glomerulonephritis (RPGN) oder schweren interstitiellen Entzündungen, kann hochdosiertes (NIH-Schema) i.v. CYC (1a/A) in Kombination mit gepulstem i.v. MP in Betracht gezogen werden.
- Lupusnephritis – Deeskalation: Bei anhaltender (renaler) Remission sollte eine schrittweise Reduktion der Therapie erwogen werden, wobei GK zuerst abgesetzt werden sollen (2a/B).
- SLE mit thrombotischem Antiphospholipidsyndrom (APS): Nach einem ersten arteriellen oder unprovozierten venösen thrombotischen Ereignis soll eine Langzeit-Antikoagulation mit Vitamin K-Antagonisten (1b/B) erfolgen. Niedrig dosierte Acetylsalicylsäure (ASS – 75-100 mg/Tag) sollte als Primärprävention bei SLE/Nicht-APS-Patienten mit Hochrisiko-aPL-Profil in Betracht gezogen werden (2a/B). Direkte orale Antikoagulantien (DOAKs) sollen gemieden werden.
- Impfungen und supportive Therapie: Impfungen zur Vorbeugung von Infektionen (HZV, HPV, Influenza, COVID-19 und Pneumokokken), das Management von Knochengesundheit, Nierenschutz und kardiovaskulärem Risiko sowie ein Screening auf bösartige Erkrankungen sollten erfolgen (-/D).
Kommentar: Vieles aus den Empfehlungen von 2019 findet sich auch in 2023 wieder. Neu ist die striktere Aufforderung, GK in der Dauertherapie, wenn (eben) möglich, ganz abzusetzen und sonst nur noch mit max. 5 mg/Tag zu geben. Auch bei der Deeskalation der Therapie sollten GK immer zuerst reduziert bzw. abgesetzt werden. Bei den i.v. GK-Pulsen am Anfang einer Induktionstherapie eines hoch-aktiven Lupus werden jetzt auch niedrigere Dosen (ab 125 mg) und nicht nur die ultrahohen Dosen von 0,5 bis 1 g Methylprednisolon empfohlen. Bei den Biologika ist Anifrolumab hinzugekommen und wird bei der Hautbeteiligung – wie auch Belimumab – explizit erwähnt. Bei der LN wird empfohlen, auch die Add-on-Therapie mit Belimumab oder einem CNI (zugelassen Voclosporin, off-label Tacrolimus) in Betracht zu ziehen und die Erhaltungstherapie nach Erreichen einer Remission noch für mindestens drei Jahre fortzuführen. Rituximab wird off-label bei (schweren) hämatologischen Manifestationen und (wie schon lange) i.v. CYC bei organ- oder lebensbedrohlicher Erkrankung bzw. bei „refraktären“ Fällen empfohlen.
Voclosporin: Ein neuer Calcineurin-Inhibitor für die Lupusnephritis
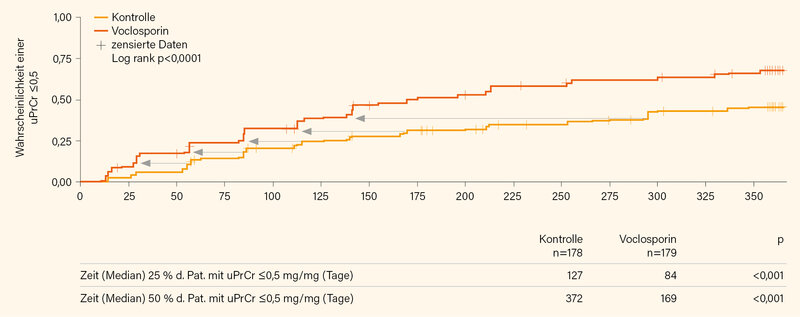
Voclosporin (VCS) ist ein neuer CNI, der zwar seit letztem Jahr auch in der EU zugelassen ist, aber erst seit diesem Frühjahr verfügbar ist. VCS weist gegenüber CsA eine stärkere Calcineurin-Inhibition auf und vor allem eine verbesserte Pharmakokinetik, die zu stabileren Wirkspiegeln führt, die man auch nicht mehr durch Blutspiegelbestimmung überwachen muss. Außerdem soll diese Substanz in ihrer Langzeitanwendung nicht so nephrotoxisch sein wie CsA. In der AURORA-Studie erhielten die Patienten neben einer Standard-Immunsuppression mit MMF (2x 1 g) und GK, die aber recht schnell zu reduzieren waren, entweder 2x täglich 23,7 mg VCS p.o. oder Placebo (PBO). Der primäre Endpunkt einer renalen Response zu Woche 52 wurde unter zusätzlicher Gabe von VCS (n=179) mit fast 41 % deutlich häufiger erreicht als unter alleiniger Gabe von MMF (n=178) mit 22,5 %. (3)
Aus anderen Studien zur LN weiß man, dass eine deutliche und rasche Absenkung der Proteinurie ein wichtiger Prognosefaktor für den renalen Langzeit-Outcome ist. Das Erreichen einer Eiweißausscheidung (uPr/Cr) ≤0,7 innerhalb von 6-12 Monaten war ein Schwellenwert, der in zwei Studien zwischen gutem und problematischem LZ-Outcome differenzieren konnte. (4, 5) Da sich der additive Effekt einer Add-on-Therapie mit VCS bei LN recht schnell zeigte (Abb. 1), erfolgte nun eine aggregierte Post-hoc-Analyse der Phase-II-Studie AURA-LV und der Phase-III-Studie AURORA, in der nur Patienten mit „großer“ Proteinurie (uPrCr ≥2) ausgewertet wurden. (6) Von 268 Patienten der VCS-Gruppe wiesen zu Studienbeginn 217 (81 %) eine uPrCr von ≥2 (im Mittel 5,2) auf, im Kontrollarm waren dies auch 81 % (215/266 mit mittlerer uPrCr von 4,6). Nach einem Jahr betrug der Rückgang der uPrCr gegenüber dem Ausgangswert 3,8 unter VCS und 3,1 im Kontrollarm. Die Differenz entspricht ca. 0,7 g Eiweißausscheidung (p=0,0003).
Kommentar: Es zeigt sich also auch in dieser Auswertung ein signifikanter Vorteil durch die zusätzliche VCS-Gabe. Es stellen sich aber zwei Fragen: Wie bedeutungsvoll ist eine uPrCr-Differenz von 0,7 innerhalb eines Jahres für die Langzeitprognose, und ist der Effekt auf eine Podozytopathie (erster, rascher Rückgang der Proteinurie) genauso prognostisch bedeutsam, wie der einer antiinflammatorischen Therapie mit MMF, welches in beiden Studienarmen die „Standardtherapie“ zur Remissionsinduktion der LN war. Aber bis zum Beweis des Gegenteils sollte man davon ausgehen, dass durch die frühzeitige Senkung der Proteinurie mehr Nierenfunktion erhalten wird.
Gegen B-Zellen gerichtete Therapien
Angesichts der starken autoimmunen Prägung des Lupus ist es nicht verwunderlich, dass immer wieder Therapien aus der Lymphom- und Myelomtherapie der Hämatologie adoptiert wurden und werden. Neben dem für die Therapie des Lupus zugelassenen Anti-BLyS/BAFF-Antikörpers Belimumab hat es aber bislang keine Anti-B-Zell-Therapie zur Zulassung gebracht. Neben Rituximab, welches nach wie vor weltweit häufig eingesetzt wird (siehe EULAR-Empfehlungen) sind auch Therapieprinzipien wie die Stammzelltransplantation (7), Proteasomen-Inhibition (8) oder Daratumumab (9) und die vor zwei Jahren erstmals beim SLE eingesetzten CAR-T-Zellen (10) als Therapien gegen Zellen der B-Zellreihe zu zählen, wobei diese auch Plasmablasten und langlebige Plasmazellen angreifen, was bei Rituximab und Belimumab nicht der Fall ist.
Ianalumab, ein neuer Antikörper gegen den BLyS/BAFF-Rezeptor
Ein weiterer Antikörper, Ianalumab, der aber nicht direkt gegen BLyS/BAFF, sondern gegen den entsprechenden Rezeptor gerichtet ist, wird und wurde schon in über 20 klinischen Studien geprüft, unter anderem bei Autoimmunhepatitis, multipler Sklerose, Immunthrombozytopenie und Sjögren-Syndrom.
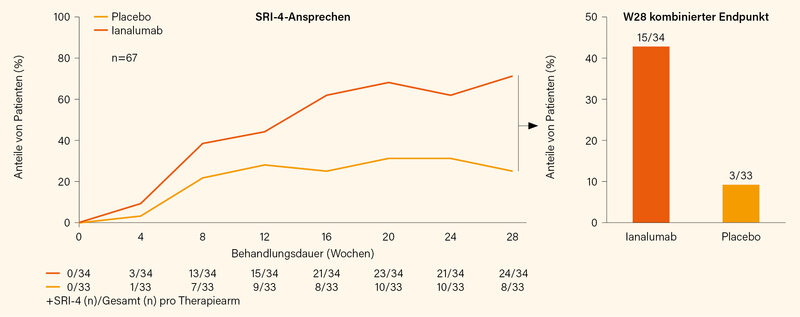
Auf dem EULAR wurde nun erstmals eine Phase-II-Studie zum Einsatz von Ianalumab beim SLE präsentiert. (11) Es werden 300 mg Ianalumab oder Placebo monatlich s.c. verabreicht. Primärer Endpunkt ist das Erreichen des SRI-4-Ansprechens und eine Dosis von max. 5 mg Predniso(lo)n tgl. bzw. nicht mehr als die Ausgangsdosis (je nachdem, was niedriger war) durchgehend von Woche 16 bis 28. In einer Zwischenanalyse der ersten 34 (von geplant 67) SLE-Patienten, die schon die Woche 28 erreicht haben, war dieser kombinierte Endpunkt (SRI-4 und GK ≤5 mg/Tag) in 44 % der Fälle unter Ianalumab gegenüber 9 % unter Placebo erreicht worden. Der SRI-4 allein, wie z. B. in den Zulassungsstudien von Belimumab verwendet, wurde unter Ianalumab in 71 % der Fälle, unter Placebo in 24 % der Fälle erreicht (Abb. 2). Bis zur Woche 20 der anschließenden, laufenden Verlängerungsstudie (LTE) seien keine schweren arzneimittelbedingten Nebenwirkungen registriert worden.
Kommentar: Eigentlich wäre diese Interimanalyse einer relativ kleinen Phase-II-Studie nicht besonders erwähnenswert, zumal schon eine Anti-BLyS-Therapie zugelassen (Belimumab) und eine andere (Tabalumab) gescheitert ist. (12) Hier handelt es sich aber um einen BLyS-Rezeptor-Antikörper, und die ersten Daten sehen durchaus vielversprechend aus, auch und gerade die Immunserologie (C3/C4, Anti-dsDNA). Es bleiben die Ergebnisse zweier Phase-III-Studien abzuwarten, die aber auch schon gestartet wurden (SIRIUS-SLE 1 & 2).
Anti-APRIL-Therapie mit Telitacicept
An dieser Stelle wurde schon öfter über eine weitere Anti-B-Zell-Therapie bei SLE berichtet, und zwar gegen APRIL (Another-Proliferation-Inducing-Ligand) mittels eines Fusionsproteins des TACI (Transmembran-Aktivator und CAML-Interaktor)-Rezeptors. Dieser ist ein Transmembranprotein der TNF-Rezeptor-Superfamilie, der neben BCMA (B-cell maturation antigen) und dem Rezeptor für BAFF (B-cell activating factor), Synonym BLyS (B-Lymphozyten-Stimulator), vorwiegend auf der Oberfläche von Zellen der B-Zellreihe zu finden ist. Hierbei scheint die Interaktion von APRIL mit TACI für die Differenzierung von Plasmablasten bzw. auch für das Überleben langlebiger Plasmazellen eine besondere Rolle zu spielen. (13)
Dies könnte erklären, warum die bisherigen Studiendaten zu diesem Therapieprinzip mit Atacicept eine ungleich stärkere Wirkung auf die Krankheitsaktivität des SLE zu belegen schienen als die „nur“ gegen BLyS/BAFF gerichteten Therapien. Dabei hatte die Anti-APRIL-Therapie aber auch zum Teil fatale unerwünschte Wirkungen, vor allem Infektionen bei ausgeprägter Absenkung der Immunglobuline (14, 15), was auch ein Beleg für die Potenz dieser Therapie sein könnte.
Das Prinzip der Anti-APRIL-Therapie wurde dann von einer chinesischen Pharmafirma übernommen, die mit Telitacicept ein ganz ähnliches Fusionsprotein hergestellt hat. In einer Phase-IIb-Studie mit 249 SLE-Patienten, die randomisiert 1x wöchentlich s.c. 80, 160, 240 mg Telitacicept oder Placebo in Kombination mit einer Standardtherapie (SOC) erhielten (16), wurde der primäre Endpunkt eines SRI-4-Ansprechens unter Placebo (n=62) in 34 % der Fälle und in den unterschiedlichen Telitacicept-Dosierungen in 71 % (80 mg), 68 % (160 mg) und 76 % (240 mg) erreicht, was für alle Dosierungen signifikant war (p<0,0001). Telitacicept führte, wie in den Studien zu Atacicept, zu einem Rückgang der B-Zellen, einem relativ prompten und deutlichen Effekt auf die Immunglobulinspiegel, die ab der 4. Woche um 30 bis 40 % abfielen und zu einer Besserung der Complementfaktoren und Anti-dsDNA-Antikörper. Es bestätigte sich also die offenbar hohe Wirksamkeit der Anti-APRIL-Therapie bei SLE und obwohl die chinesische Studie noch nicht als Full-Paper veröffentlicht war, hatte die FDA Telitacicept im April 2020 eine sog. Fast-Track-Designation zuerkannt und im März 2021 wurde Telitacicept von der chinesischen Gesundheitsbehörde zur Behandlung des SLE zugelassen.
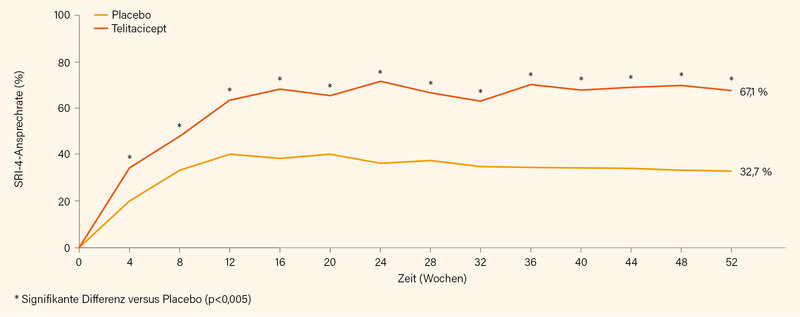
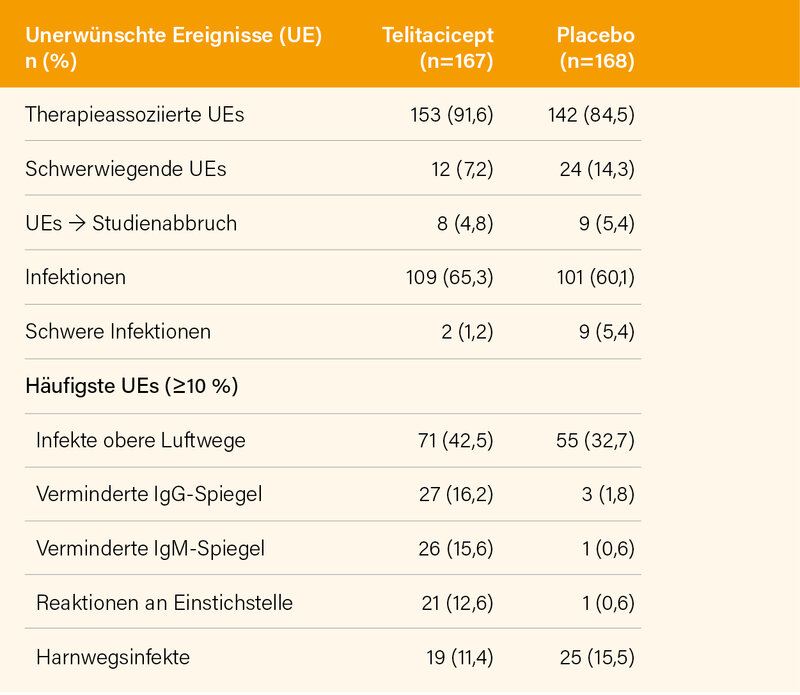
Nachdem sie auf dem letzten ACR-Meeting nur als Late-Breaking Poster vorgestellt wurde, berichtete nun Ronald van Vollenhoven, Amsterdam (Niederlande), der die Studiendaten für die FDA analysiert hat, jetzt auf dem EULAR über eine prospektive, doppelblinde, randomisierte Phase-III-Studie aus China zu Wirksamkeit und Sicherheit von 160 mg Telitacicept pro Woche s.c. (oder Placebo) in Kombination mit einer SOC bei SLE. (17) Einschlusskriterien waren ein Alter zwischen 18 und 65 Jahren und aktiver SLE (SELENA-SLEDAI ≥8). Der primäre Endpunkt war wieder das SRI-4-Ansprechen in Woche 52. Randomisiert wurden 335 Patienten, 167 erhielten Telitacicept und 168 Placebo. 236 (70,4 %) schlossen die 52-wöchige Behandlung ab. Der primäre Endpunkt einer SRI-4-Response in Woche 52 wurde mit 82,6 % signifikant häufiger unter Telitacicept erreicht als unter Placebo (+SOC) mit 38,1 % (p<0,001). Auch wenn man sämtliche fehlende Daten als Non-Response wertete, war der Unterschied mit 67,1 vs. 32,7 % immer noch signifikant (Abb. 3). Auffällig war in dieser Studie auch der bereits früh (Woche 4) einsetzende Unterschied der SRI-4-Response im Vergleich zur der Placebo-Gruppe und korrespondierend hierzu der rasche Rückgang der IgG-Spiegel bei (gegenüber z. B. Rituximab) nur langsamem Rückgang der B-Zellen. Ein Anstieg der Complementfaktoren C3 und C4 war wiederum schon in der 4. Woche zu erkennen. Die Safety-Daten (Tab. 2) zeigen einerseits wieder den Effekt der Anti-APRIL-Therapie auf die Immunglobuline und andererseits wie viel besser die Ergebnisse sind, wenn man weiß, womit man an „Nebenwirkungen“ zu rechnen hat.
Kommentar: Auch wenn es zur Anti-APRIL-Therapie bei SLE nunmehr seit über 10 Jahren (Atacicept) klinische Daten gibt, welche einerseits für eine Wirksamkeit, andererseits aber auch für ein gewisses Risiko sprechen, wurde nur in China mit Telitacicept dieses Therapieprinzip weiterverfolgt. Aufgrund der ersten Phase-II-Studie hatte die FDA Telitacicept im April 2020 eine sog. Fast-Track-Designation zuerkannt. Die hier vorgestellte Phase-III-Studie ist nach wie vor noch nicht als Paper veröffentlicht (Stand 07/2023). Eine weltweite Phase-III-Studie (REMESLE-1) mit Telitacicept ist in den USA aber Ende 2022 angelaufen.
CAR-T-Zell-Therapie (nicht nur beim SLE)
Seitdem die Erlanger Arbeitsgruppe um Georg Schett über den weltweit ersten Einsatz von Chimären Antigenrezeptor-T (CAR-T)-Zellen zur Therapie des SLE berichtet hat, welche den ebenfalls B-Zell-spezifischen Oberflächenmarker CD19 erkennen (10), wurden dort weitere 6 SLE-Patienten und auch einzelne mit Antisynthetase-Syndrom und SSc so behandelt. Weitere Zentren stehen „in den Startlöchern“, um diese aufwändige Therapie im Rahmen einer multizentrischen prospektiven Studie bei ausgesuchten Fällen schwerer Autoimmunerkrankungen zu prüfen.
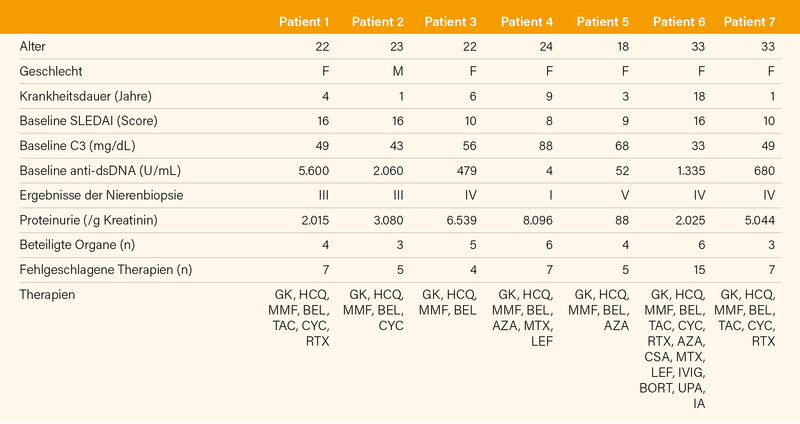
Auf dem diesjährigen EULAR-Kongress hat Schett die Daten von den inzwischen 7 SLE-Patienten vorgestellt. (18) Die klinischen Charakteristika und Vortherapien sind in Tab. 3 aufgeführt. Alle 7, zuvor hoch-aktiven SLE-Patienten erreichten eine therapiefreie (!) Vollremission mit einem SLEDAI von 0, wobei bislang erst 5 der 7 Patienten eine Nachbeobachtungsdauer von mindestens 1 Jahr erreicht haben. Zu Reaktivierungen (Schüben) ist es bislang nicht gekommen. Innerhalb von 3 Monaten kam es zum Rückgang von Proteinurie und Anti-dsDNA-Antikörpern sowie einem Anstieg von Complementfaktoren.
Von derselben Arbeitsgruppe wurden als Poster auch die Daten zur CAR-T-Zell-Therapie bei 2 Patienten mit Anti-Synthetase (Jo-1)-Syndrom (19) und als Abstract bei 1 Patienten mit schwerer diffuser, Anti-RNA-Polymerase III positiver SSc vorgestellt (20). Bei letzterem normalisierten sich die ANA und Anti-RNA-Polymerase III-Antikörper nach drei Monaten. Eine myokardiale Tracer-Aufnahme in der 68Ga-FAPI-04-PET-CT-Bildgebung, welche mit der Fibroblastenaktivierung korreliert, reduzierte sich um 30 %. Das Ausmaß der Lungenfibrose im CT-Scan und die Lungenfunktionsparameter waren stabil oder leicht verbessert. (20)
Kommentar: Die Daten zum Einsatz CD19-spezifischer CAR-T-Zellen sind sicher spektakulär. Dennoch stellen sich einige Fragen zur genaueren Einstufung dieser innovativen Behandlung: Ist die therapiefreie Vollremission auch von längerer Dauer? Wie sind die Ergebnisse im Vergleich zur wesentlich einfacheren, wiederholten Gabe eines monoklonalen Antikörpers gegen CD19? Wie sind die Ergebnisse mit reduzierter oder sogar fehlender Konditionierungstherapie mit Fludarabin und CYC? SLE-Patienten, die einen auf die CAR-T-Zell-Therapie ansprechen, wissen so gut wie nie, dass diese die Notwendigkeit einer „Chemotherapie“ mit sich bringt. Diese ist allerdings nicht so hoch dosiert wie z. B. bei einer Stammzelltransplantation.
Prof. Dr. med. Christof Specker
Klinik für Rheumatologie & Klinische Immunologie
Evangelisches Krankenhaus,
Pattbergstraße 1-3, 45239 Essen
Literatur: 1 Del Galdo F et al., 2023 Update of EULAR Recommendations for the Treatment of Systemic Sclerosis. Ann Rheum Dis 2023; 82 (Suppl. 1): 154 (OP0234) | 2 Boumpas D et al., EULAR-Recommendations on the Management of Lupus. EULAR oral presentation, Mailand, 3. Juni 2023. | 3 Rovin BH et al., Lancet 2021; 397(10289): 2070-2080 | 4 Dall'Era M et al., Arthritis Rheumatol 2015; 67(5): 1305-1313 | 5 Tamirou F et al., Lupus Sci Med 2015; 2(1): e000123 | 6 Littlejohn E et al., Ann Rheum Dis 2023; 82 (Suppl. 1): 273 (POS0116) | 7 Alexander T et al., Blood 2009; 113(1): 214-223 | 8 Alexander T et al., Ann Rheum Dis 2015; 74(7): 1474-1478 | 9 Ostendorf L et al., N Engl J Med 2020; 383(12): 1149-1155 | 10 Mougiakakos D et al., N Engl J Med 2021; 385(6): 567-569 | 11 Cortés-Hernández J et al., Ann Rheum Dis 2023; 82 (Suppl. 1): 275 (POS0120) | 12 Isenberg DA et al., Ann Rheum Dis 2016; 75(2): 323-331 | 13 Tsuji S et al., Blood 2011; 118(22): 5832-5839 | 14 Ginzler EM et al., Arthritis Res Ther 2012; 14(1): R33 | 15 Isenberg D et al., Ann Rheum Dis 2015; 74(11): 2006-2015 | 16 Wu D et al., Arthritis Rheumatol 2019; 71 (Suppl. 10): Abstract L18 | 17 Wang L et al., Ann Rheum Dis 2023; 82 (Suppl. 1): 90 (OP0137) | 18 Taubmann J et al., Ann Rheum Dis 2023; 82 (Suppl. 1): 93 (OP0141) | 19 Taubmann J et al., Ann Rheum Dis 2023; 82 (Suppl. 1): 957 (POS01238) | 20 Bergmann C et al., Ann Rheum Dis 2023; 82 (Suppl. 1): 1621 (AB0816)