Frühe Intervention bei präklinischer RA sinnvoll?
Die präklinische Phase der RA ist durch das Vorliegen von ACPA, subklinischer Arthritis und Schmerzen gekennzeichnet. ACPA-positive Personen mit entzündlichen oder strukturellen Läsionen in der Bildgebung haben ein hohes Risiko für den Übergang zur manifesten RA. Ob bereits zu diesem Zeitpunkt interveniert werden soll, ist strittig. Da die T-Zell-vermittelte B-Zell-Aktivierung ein wichtiger Trigger für die Entwicklung einer RA ist, wäre Abatacept eine interessante frühe Therapieoption zum Aufhalten dieses Prozesses, da es die Aktivierung von T-Zellen unterbricht und recht gut verträglich ist. Eine internationale Gruppe um Jürgen Rech, Erlangen, prüfte daher in der randomisierten, doppelblinden, placebokontrollierten ARIAA-Studie, ob der T-Zell-Costimulationsmodulator Abatacept bei ACPA-positiven Patienten ohne RA, aber mit Entzündung im MRT (und hohem Risiko für RA) die subklinische Arthritis zurückfahren kann. Zwischen 2014 und 2019 wurden in 14, vorwiegend deutschen Zentren 100 Patienten für 6 Monate auf wöchentlich s.c. Abatacept s.c. 125 mg oder Placebo randomisiert mit nachfolgendem 12-monatigen Follow-up ohne Therapie. Primärer Endpunkt (in der ITT-Population; n=98) war eine Verbesserung in mindestens einem MRT-Entzündungsparameter (jede Veränderung ab Baseline >0 bei Synovitis, Tenosynovitis und Osteitis) gemäß dem RAMRIS-Score.
Der primäre Endpunkt wurde erreicht: Zu einer Verbesserung von mindestens einem der genannten Kriterien kam es bei 61 % der Patienten unter Abatacept und 31 % unter Placebo (p=0,0043). Wohl noch wichtiger: Eine manifeste Arthritis entwickelten 17 Patienten in der Placebogruppe, aber nur 4 im Abatacept-Arm (34,7 vs. 8,2 %; p=0,0025). Somit verbessert Abatacept signifikant die subklinische Arthritis bei Patienten mit hohem RA-Risiko, was die Hypothese stützt, dass eine frühe medikamentöse Intervention der Entwicklung einer RA entgegenwirken oder diese wenigstens verzögern kann. (1) Dennoch bleibt zu konstatieren, dass auch im Placeboarm nur eine Minderheit der Teilnehmer eine RA entwickelte, sodass eine Übertherapie nicht auszuschließen ist – die Diskussion wird also sicher weitergehen.
Olokizumab: Gute Wirksamkeit und Sicherheit in Phase-III
Nach den positiven Daten einer ersten Phase-III-Studie, CREDO1, bei Patienten mit Versagen auf Methotrexat (MTX), die den IL-6-Inhibitor vorwiegend im osteuropäischen Raum getestet hatte, wurden jetzt auf dem ACR die beiden globalen Phase-III-Studien CREDO2 und CREDO3 nachgelegt. Zunächst zu der randomisierten, doppelblinden, aktiv- und placebokontrollierten CREDO2-Studie, die von Eugen Feist, Vogelsang-Gommern, und Kollegen präsentiert wurde. In dieser wurden 1.648 Patienten (im Mittel 45 Jahre, 78 % Frauen, Krankheitsdauer >7 Jahre, DAS28-CRP 5,8) mit aktiver RA trotz Methotrexat (MTX) im Verhältnis 2:2:2:1 für 24 Wochen auf s.c. Olokizumab 64 mg alle 2 (q2w) bzw. alle 4 Wochen (q4w), Adalimumab 40 mg q2w oder Placebo randomisiert (jeweils plus MTX), danach folgte ein 20-wöchiges Follow-up. Primärer Endpunkt war das ACR20-Ansprechen in Woche 12, sekundäre Endpunkte in Woche 12 waren ein DAS28-CRP <3,2 (niedrige Krankheitsaktivität) und der ΔHAQ-DI, in Woche 24 ein ACR50-Ansprechen und Remission gemäß einem CDAI ≤2,8.
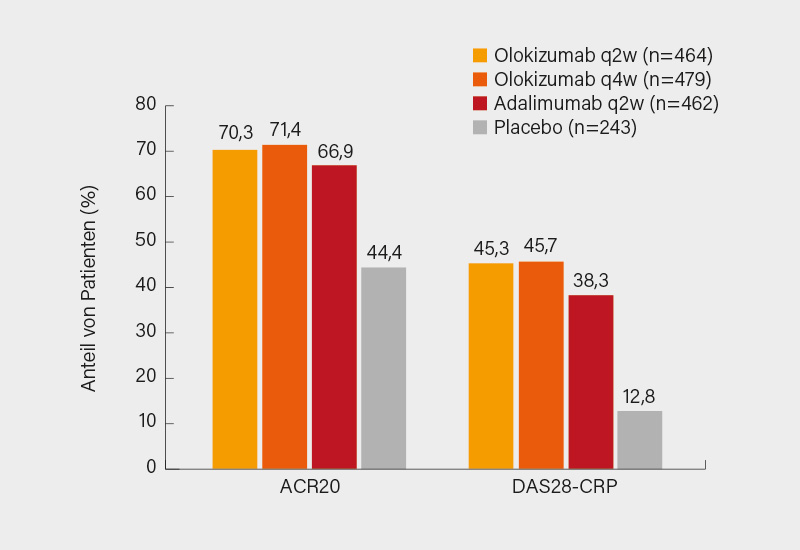
Gut 90 % der Patienten schlossen die 24-wöchige Phase ab, und ca. 86 % gingen in das Follow-up ein. Beide Olokizumab-Regime zeigten sich Placebo im primären und allen sekundären Endpunkten signifikant überlegen (meist p<0,001) und gegenüber Adalimumab in den vorab definierten Endpunkten ACR20 und DAS28-CRP <3,2 nicht unterlegen (mit teilweise numerischen Vorteilen). Ein ACR20-Ansprechen in Woche 12 erreichten 70,3 % (q2w), 71,4 % (q4w), 66,9 % (Adalimumab) und 44,4 % (Placebo) der Patienten, eine niedrige Krankheitsaktivität gemäß DAS28-CRP <3,2 45,3 und 45,7 % vs. 38,3 und 12,8 % (Abb.). In Woche 24 betrug das ACR50-Ansprechen 50,4 und 50,1 % vs. 46,3 bzw. 22,6 %, eine CDAI-Remisison ≤2,8 erreichten 11,2 und 12,1 % vs. 13,0 bzw. 4,1 % der Teilnehmer. Zu therapieassoziierten unerwünschten Ereignissen (TEAE), kam es bei 70,0 und 70,9 % vs. 65,4 (Adalimumab) bzw. 63,4 % (Placebo) der Patienten, zum Abbruch führten diese bei 4,5 und 6,3 % vs. 5,6 bzw. 3,7 %. Die häufigsten schweren TEAE waren Infektionen. Somit kann Olokizumab eine gute Wirksamkeit auf Augenhöhe mit Adalimumab attestiert werden, bei recht guter Verträglichkeit gab es keine neuen Sicherheitssignale. (2)
Kleiner war die randomisierte, doppelblinde, placebokontrollierte CREDO3-Studie, die ebenfalls Eugen Feist vorstellte. Hierin eingeschlossen wurden 368 Patienten mit mäßiger bis schwerer aktiver RA und unzureichendem Ansprechen auf TNFα-Inhibitoren (im Mittel 53 Jahre, >80 % Frauen, Krankheitsdauer ca. 11 Jahre, DAS28-CRP 6,0). Diese wurden on top von MTX im Verhältnis 2:2:1 für 24 Wochen auf s.c. Olokizumab 64 mg q2w bzw. q4w oder Placebo randomisiert (wieder mit 20-wöchigem Follow-up). Der primäre und die sekundären Endpunkte waren identisch mit jenen in CREDO2, wurden aber jeweils in Woche 12 erfasst.
Beide Olokizumab-Regime waren im primären Endpunkt (ACR20 in Woche 12) Placebo signifikant überlegen (60,9 und 59,6 vs. 40,6 %; p=0,003 bzw. 0,004), ebenso im DAS28-CRP ≤3,2 (39,9 und 28,0 vs. 11,6 %; p<0,001 bzw. =0,004). Die Unterschiede im ΔHAQ-DI bis Woche 12 waren nur für das 2-wöchentliche Regime signifikant. Ein ACR50-Ansprechen und einen CDAI ≤2,8 in Woche 12 erreichten 33,3 und 32,3 vs. 15,9 % bzw. 6,5 und 3,1 vs. 0 % der Patienten. TEAE waren unter Olokizumab q2w und q4w etwas häufiger (65,5 und 65,0 vs. 50,7 %), aber meist nur mild bis mäßig ausgeprägt. Zu schweren TEAE (meist Infektionen) kam es bei 7,0 und 3,2 vs. 0 %. Schwere opportunistische Infektionen, kardiovaskuläre Komplationen, gastrointestinale Perforationen oder Todesfälle blieben aus. Die Wirksamkeit und Sicherheit von Olokizumab war auch in dieser Phase-III-Studie gut, einer Zulassung ist man deutlich näher gekommen. (3) Ob die Effektivität wirklich an jene der IL-6-Rezeptor-Inhibitoren heranreicht, könnte nur eine Head-to-head-Studien klären.
Update zu JAK-Inhibitoren und bDMARDs
Im Rahmen der von Manuel Pombo-Suarez, Santiago de Compostela (Spanien), vorgestellten JAK-pot-Studie (14 internationale Real-World-Register) wurde in einer genesteten Kohortenstudie untersucht, ob nach Versagen eines ersten JAK-Inhibitors auf einen zweiten oder ein bDMARD gewechselt werden sollte. Prospektiv wurden bei 708 RA-Patienten die Retentionsraten und der DAS28-Verlauf über 12 Monate nach dem Switch (154 auf zweiten JAK-Inhibitor, 554 auf ein bDMARD) erfasst. Auf den zweiten JAK-Inhibitor wechselnde Patienten waren älter und länger erkrankt, hatten mehr bDMARDs und eine längere Exposition auf den ersten JAK-Hemmer als jene, die auf ein bDMARD wechselten. Trotz des schwierigeren Patientenprofils und häufigerer JAK-Inhibitor-Monotherapien waren die Retentionsraten und DAS28-Verläufe vergleichbar. Im Trend war ein Abbruch des zweiten JAK-Inhibitors wahrscheinlicher nach Nebenwirkungen (und nicht Ineffektivität) unter dem ersten. (4)
Eine von niederländischen Rheumatologen um Nathan den Boeder, Nijmegen, vorgestellte Extension der REDO-Studie mit 118 der ursprünglich 142 RA-Patienten ergab nach einem mittleren Follow-up von 3,2 Jahren, dass (sehr) niedrige Rituximab-Dosen (200 bzw. 500 vs. 1.000 mg alle 6 Monate) eine vergleichbar gute Krankheitskontrolle gestatteten. (5)
GLORIA-Studie: Sind Low-dose-GK sicher?
Einen großen Raum auf dem ACR nahmen auch jenseits der Diskussionen rund um Tofacitinib aus der ORAL Surveillance-Studie Sicherheitsaspekte rund um die RA-Therapie ein. In der von Marteen Boers, Amsterdam (Niederlande), und Kollegen vorgestellten pragmatischen, randomisierten, doppelblinden, placebokontrollierten GLORIA-Studie war bei 451 älteren RA-Patienten (≥65 Jahre; im Mittel 72 Jahre, 70 % Frauen, Krankheitsdauer 11 Jahre, 96 % mit röntgenologischen Veränderungen, DAS28 4,5) untersucht worden, ob niedrig dosiertes Prednisolon zusätzlich zu DMARDs ein positives Nutzen/Risiko-Profil (Verbesserung im DAS28 und Hemmung radiologischer Progression im Sharp/van der Heijde-Score vs. AE) aufweist. Ein klares Ergebnis gibt es nicht: Signifikanten Vorteilen im ΔDAS28 über 24 Monate (-0,37; p<0,001) und bei der radiologischen Progression (-1,7 Punkte; p=0,003) stehen mehr AE (60 vs. 49 %; relativer Anstieg des Risikos um 24 %), meistens minderschwere Infektionen, gegenüber. Letztlich bleibt es eine individuelle Entscheidung, aber auch in einem älteren Kollektiv erscheint es sinnvoller, konsequent b- oder tsDMARDs anstelle einer langfristigen Low-dose-GK-Therapie einzusetzen. (6)
Quellen:
1 Arthritis Rheumatol 2021; 73 (Suppl 10): Abstr. 0455
2 Arthritis Rheumatol 2021; 73 (Suppl 10): Abstr. 1685
3 Arthritis Rheumatol 2021; 73 (Suppl 10): Abstr. 1686
4 Arthritis Rheumatol 2021; 73 (Suppl 10): Abstr. 1442
5 Arthritis Rheumatol 2021; 73 (Suppl 10): Abstr. 1443
6 Arthritis Rheumatol 2021; 73 (Suppl 10): Abstr. 1678