Nur kurz erwähnt sei eingangs der von Robert B. M. Landewé, Amsterdam (Niederlande), vorgetragene Ausblick auf das anstehende Update der EULAR-Empfehlungen zum Management von ERE-Patienten im Kontext von SARS-CoV-2, das eher wenig Neues zu bieten scheint – hier sei auf die aktuellen Handlungsempfehlungen der DGRh verwiesen.
Effekte von Biologika und JAK-Inhibitoren auf Schwere von COVID-19
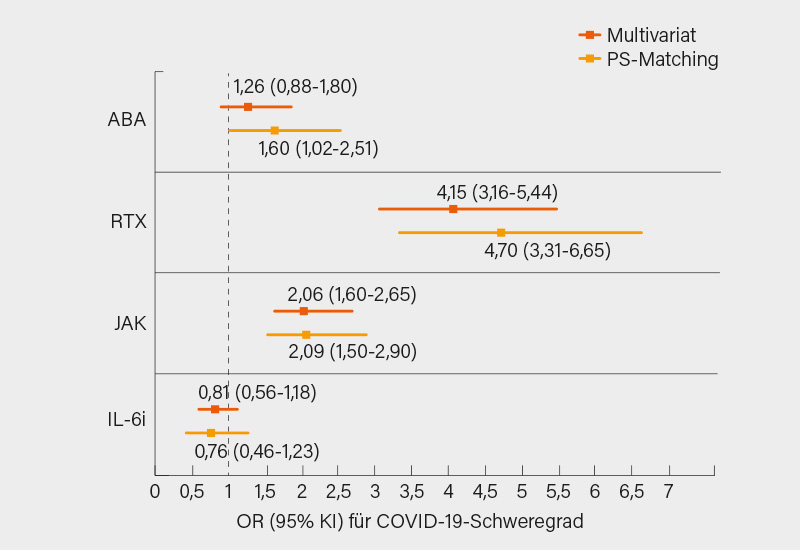
Aufschlussreich und auch etwas überraschend waren die von Jeffrey Sparks, Boston (USA), vorgestellten und bereits kurz vor dem Kongress publizierten Daten aus dem COVID-19 GRA-Register zur Assoziation von bDMARDS und tsDMARDs mit dem Verlauf von COVID-19 bei Patienten mit rheumatoider Arthritis (RA). Analysiert wurden von März 2020 bis zum April 2021 2.869 RA-Patienten auf b/tsDMARDs (im Mittel 57 Jahre, 81 % Frauen, 20 % Raucher, 12 % adipös, 28 % auf Glukokortikoiden [GK], 49 % mit begleitenden csDMARDs, meist Methotrexat [MTX], 18 % mit mäßiger bis hoher Krankheitsaktivität), von denen zum Zeitpunkt des Beginns der COVID-19-Erkrankung 237 Abatacept, 364 Rituximab, 563 Januskinase (JAK)-Inhibitoren (JAKi), 317 Interleukin (IL)-6-Rezeptor-Inhibitoren (IL-6Ri:Tocilizumab, Sarilumab) und 1.388 TNFα-Inhibitoren (TNFi) erhielten. Patienten auf Rituximab hatten gegenüber jenen auf TNFi häufiger eine interstitielle Lungenerkrankung (ILD: 7,4 vs. 0,9 %), jene auf JAKi versus TNFi waren häufiger adipös (15,1 vs. 10,3 %). Primärer Endpunkt war der COVID-19-Schweregrad gemäß einer Ordinalskala (1 = keine Hospitalisierung, 2 = Hospitalisierung ohne O2-Bedarf, 3 Hospitalisierung mit O2/Beatmung, 4 = Tod). Die Odds Raten (OR) für die Wirkstoffklassen gegenüber TNFi als Referenz wurden mittels logistischer Regression und adjustiert auf Baseline-Faktoren (u. a. Alter, Geschlecht, RA-Charakteristika, Begleittherapien und Komorbiditäten) ermittelt.
Bereits in einer multivariaten Analyse waren Rituximab (OR 4,15) und auch JAKi (OR 2,06) mit signifikant höheren OR für den primären Endpunkt gegenüber TNFi verbunden, geringer war das Risiko unter IL-6Ri (OR 0,81), etwas erhöht unter Abatacept (OR 1,26) (Abb. 1). Dies änderte sich auch durch den Ausschluss von ILD oder Malignitäten nicht wesentlich. In einer Propensity-Score gematchten Analyse war nur unter IL-6Ri die Wahrscheinlichkeit für ein schlechtes COVID-19-Outcome im Trend geringer (OR 0,76), unter Rituximab (OR 4,70), JAKi (OR 2,09) und Abatacept (OR 1,60) war es dagegen signifikant höher (Abb. 1). Im Hinblick auf das Risiko für eine Hospitalisierung, Hospitalisierung mit O2-Bedarf oder Beatmung, mechanische Beatmung und Tod zeigte sich nur für Rituximab (ORs 4,53, 2,87, 4,05 bzw. 4,57) und JAKi (ORs 2,40, 1,55, 2,03 bzw. 2,04) ein konsistent höheres Risiko. Im Ergebnis zeigte sich damit erwartungsgemäß ein höheres Risiko unter Ritxuimab (4-fach!), unter JAKi, war es etwa doppelt so hoch – letzterer Befund war überraschend und sollte noch verifiziert werden, die Gründe hierfür sind noch unklar. (1, 2)
In diesem Kontext kurz erwähnt sei eine neue Analyse das deutschen COVID-19 Rheuma-Registers, die von Rebecca Hasseli, Bad Nauheim, vorgestellt wurde und sich mit dem potenziell niedrigeren Risiko für schlechte COVID-19-Verläufe unter TNFi bei Patienten mit ERE befasste. Es wurden 483 TNFi-Patienten 1.524 Fällen mit anderen Immunmodulatoren (OID) gegenübergestellt (zu über 50 % handelte es sich um eine RA). GK erhielten 19 bzw. 44 %. Bei Patienten unter TNFi war im Vergleich zu jenen auf OID sowohl das Risiko für eine COVID-19 bedingte Hospitalisierung (10 vs. 26 %), invasive Beatmung (1 vs. 6 %) als auch einen tödlichen Verlauf (0,2 vs. 5,3 %) markant niedriger. Bei jenen Patienten unter TNFi, die hospitalisiert werden mussten, war die gleichzeitige GK-Einnahme und Rate einer hohen Krankheitsaktivität signifikant höher, was erneut ein erhöhtes Risiko von Patienten auf GK (vor allem wenn hoch dosiert) und mit (mäßiger bis) hoher Krankheitsaktivität bestätigt. (3)
Erste Daten zur Sicherheit und Effektivität von COVID-19-Impfungen
Erfreuliche Daten stellte Pedro M. Machado, London (Großbritannien), zur Sicherheit von COVID-19-Impfungen bei ERE-Patienten aus dem EULAR COVAX-Register vor. Bis zum 27. April konnten 1.519 Patienten (im Mittel 63 Jahre, 68 % Frauen, u. a. 30 % mit RA, je 8 % mit axialer Spondyloarthritis [axSpA], und Psoriasis-Arthritis [PsA], 19 % mit Kollagenosen, meistens einem systemischen Lupus erythematodes [SLE] und 16 % mit Groß- oder Kleingefäßvaskulitiden) eingeschlossen werden, auf csDMARDs, bDMARDs, JAKi und GK waren 45, 36, 3 bzw. 31 % eingestellt, andere Immunsuppressiva erhielten 6 %. Die am häufigsten eingesetzten DMARDs waren MTX (29 %), TNFi (18 %), Antimalariamittel (10 %) und Rituximab (6 %). Die Impfung erfolgte überwiegend mit der Biontech/Pfizer-Vakzine (78 %), gefolgt von AstraZeneca (16 %) und Moderna (5 %), 66 % hatten bereits beide Dosen erhalten. Nur in 1 % der Fälle wurde nach der Vakzinierung eine COVID-19-Diagnose gestellt. Zu Schüben der Grunderkrankung (im Mittel nach 5 Tagen) kam es nur bei 5 % der Patienten (Arthritis 2,5 %, Arthralgie 2,1 %, kutan oder mehr Fatigue je 0,8 %), als schwer wurden diese bei 1,2 % eingestuft. Bei 31 % kam es zu typischen unerwünschten Ereignissen (UE: Schmerzen an Einstichstelle 19 %, Fatigue 11 %, Kopfschmerzen 7 %, muskuläre Beschwerden 6 %), systemische Effekte zeigten sich bei 2 %, schwere UE bei 0,1 %. Damit zeigte sich ein gutes und mit der Allgemeinbevölkerung durchaus vergleichbares Sicherheitsprofil der Impfung gegen COVID-19, was Rheumatologen und deren Patienten gleichermaßen beruhigen sollte. (4)
Aufschlussreich war eine große multizentrische Beobachtungsstudie israelischer Rheumatologen um Victoria Furer, Tel Aviv, zur Immunogenität, Wirksamkeit und Sicherheit der Biontech/Pfizer-Vakzine bei ERE-Patienten im Vergleich zur Allgemeinbevölkerung ohne rheumatische Erkrankung oder immunsuppressive Therapie, die gleichfalls als Late-breaking Abstract präsentiert und unmittelbar vor dem Kongress publiziert wurde. In die prospektive Studie wurden 686 ERE-Patienten (69 % Frauen, im Mittel 59 Jahre, mit RA, axSpA, PsA, SLE, Kollagenosen, Vaskulitiden und idiopathischen entzündlichen Myopathien [IIM]) sowie 121 Kontrollen eingeschlossen, die beide Dosen der mRNA-Vakzine erhalten hatten. Die ERE-Patienten waren signifikant älter als die Kontrollen (56,8 vs. 50,8 Jahre; p<0,0001). Die Serum IgG-Antikörperspiegel gegen die SARS-CoV-2 Spike S1/S2-Proteine wurden jeweils 2-6 Wochen nach der zweiten Impfdosis bestimmt. Eine Seropositivität war definiert als IgG ≥15 bindende Antikörper-Einheiten (BAU)/ml. Die Effektivität wurde bestimmt anhand von COVID-19-Infektionen nach der Impfung, erfasst wurde zudem die Krankheitsaktivität (RA: SDAI, CDAI; PsA: DAPSA, PASI etc., axSpA: BASDAI, ASDAS; SLE: SLEDAI, IIM und Vaskulitis: PhGA/PtGA) vor und nach der Vakzinierung. 95,2 % der ERE-Patienten erhielten immunmodulatorische Therapien, am häufigsten eingesetzt wurden GK (19 %), MTX (26 %), TNFi
(25 %) und Rituximab (13 %).
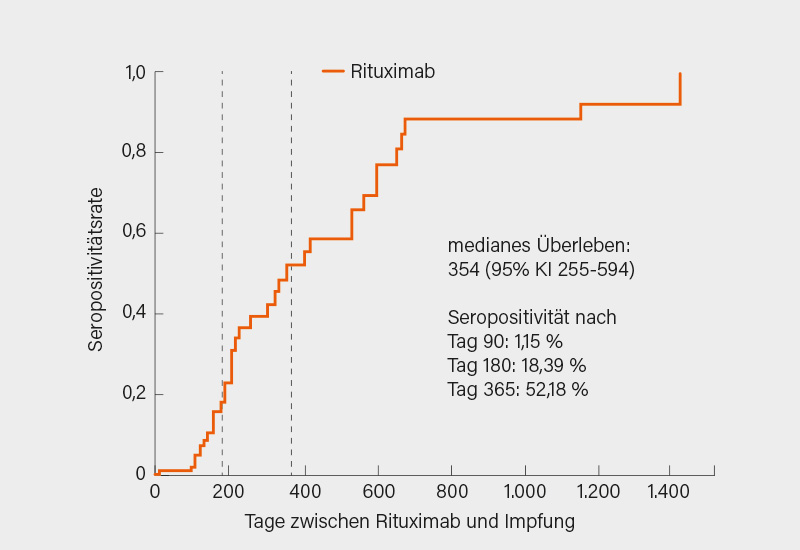
Im Ergebnis zeigte sich eine niedrigere Rate der Seropositivität bei den ERE-Patienten im Vergleich zu den Kontrollen (86 vs. 100 %; p<0,0001). Auch der S1/S2-Antikörperspiegel war signifikant geringer (132,9 vs. 218,6; p<0,0001). Bei Patienten mit PsA, axSpA, SLE und Großgefäßvaskulitiden lag die Seropositivitäts-Rate über 90 %, bei RA betrug sie 82,1 %, am niedrigsten war sie bei den Teilnehmern mit ANCA-assoziierten Vaskulitiden (AAV) und IIM mit unter 40 %. Frühere Befunde bestätigend beeinträchtigte Rituximab signifikant und am stärksten die Immunogenität der Vakzine und resultierte in der niedrigsten Seropositivitäts-Rate (39 %; p<0,001) – ein Befund, der stark vom zeitlichen Abstand zwischen letzter Rituximab-Infusion und Impfung abhing (1,2 % nach 90, 18,4 % nach 180 und 52,2 % nach 365 Tagen) (Abb. 2). Auch der Einsatz von GK (p=0,0151), Mycophenolat Mofetil (MMF) (p=0,0019) und Abatacept (p=0,007) – letztere aber mit kleinen Fallzahlen – war mit einer signifikant niedrigeren Seropositivität assoziiert. Geringer, aber gleichfalls signifikant erniedrigt war die Rate für MTX als Mono- und Kombinationstherapie (92 bzw. 84 %). Mehr als 97 % der mit TNFi, IL-6Ri und IL-17i als Monotherapie behandelten Patienten hatten ein adäquates Impfansprechen. Bei Kombination von TNFi mit MTX kam es zu einer leichten, aber signifikanten Abnahme der Seropositivität auf 93 % (p=0,04). Ein Alter >65 Jahre, die Diagnose einer RA, IIM und AAV sowie Therapie mit GK, MMF, Rituximab und Abatacept waren letztlich mit einer reduzierten Wahrscheinlichkeit für Seropositivität assoziiert. Die Effektivität der mRNA-Vakzine war sehr gut, es kam nur bei einem ERE-Patienten zu einer symptomatischen Infektion (mit allerdings letalem Verlauf) sowie einer Infektion mit mildem Verlauf in der Kontrollgruppe. Spezielle UE im Arm der ERE-Patienten waren Uveitis (n=2), Herpes Zoster (n=6) und eine Perikarditis, drei Patienten verstarben nach der zweiten Dosis. Bei der großen Mehrzahl der ERE-Patienten (60-90 %) blieb die Krankheitsaktivität stabil, die Anteile von solchen mit einer Verbesserung oder Verschlechterung hielt sich die Waage. Somit zeigt sich bei akzeptablem Sicherheitsprofil eine überwiegend gute Wirksamkeit der Impfung auch bei ERE-Patienten, deutliche Einschränkungen gibt es unter Rituximab (hier scheint, wenn möglich, eine verzögerte Gabe nach der Impfung sinnvoll) und in geringerem Umfang bei mit GK, Abatacept und MMF behandelten Patienten. (5, 6)
COVID-19-Pneumonie: Mavrilimumab verbessert Therapieergebnisse
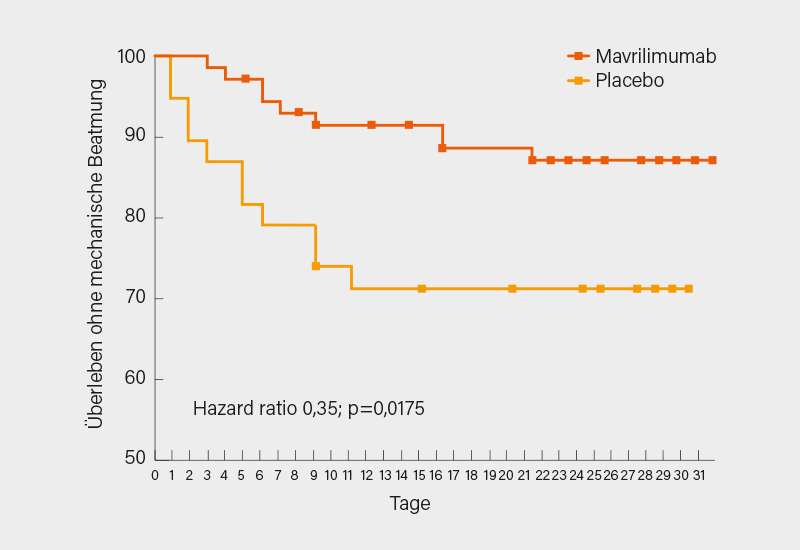
Auch wenn es noch eine Reihe weiterer interessanter Studien zu dieser Thematik gab, sei zum Schluss noch eine Phase-II-Studie zu dem GM-CSF-Ri Mavrilimumab erörtert. Derzeit mit einigem Erfolg auch in Phase-II bei Riesenzellarteriitis geprüft, lagen bereits im letzten Jahr erste Studiendaten zu dessen Einsatz auch bei Patienten mit COVID-19-assoziierte Pneumonie und systemischer Hyperinflammation vor. Systematisch erfasst wurden dessen Effekte bei hospitalisierten Patienten mit schwerer COVID-19-Pneumonie mit und ohne mechanische Beatmung von Lara Pupim, Lexington (USA), und Kollegen in einer noch andauernden, weltweiten, randomisierten, placebokontrollierten Phase-II/III-Studie. Die hier berichtete Kohorte umfasste 116 Patienten ohne mechanische Beatmung (im Mittel 57 Jahre, 43 % Frauen, 49 % mit BMI ≥30), die zusätzlich zu einer Standardtherapie (96 % GK/Dexamethason, 29 % Remdesivir) im Verhältnis 1:1:1 i.v. 6 oder 10 mg/kg Mavrilimumab oder Placebo erhielten. Primärer Effektivitäts-Endpunkt war der Anteil überlebender Patienten ohne mechanische Beatmung an Tag 29.
Bei gemeinsamer Auswertung beider Mavrilimumab-Dosierungen (zwischen diesen gab es keinen Unterschied) erreichten darunter 12,3 % mehr Patienten den primären Endpunkt an Tag 29 (86,7 vs. 74,4 %; p=0,1224), auch die Mortalität alleine war geringer (8 vs. 21 %; p=0,0718). Bis Tag 29 kam es unter Mavrilimumab zu einer 65%igen Reduktion des Risikos für mechanische Beatmung oder Tod (Hazard ratio, HR 0,35; p=0,0175) (Abb. 3) und zu einer 61%igen Reduktion des Risikos für Tod (HR 0,39; p=0,0726). Auch in sekundären Endpunkten (Zeit bis zu klinischer Verbesserung um 2 Punkte auf NIAID-Skala bzw. bis kein O2 mehr gegeben werden musste) zeigten sich im Trend Vorteile. Die Verträglichkeit war gut, zu UE inklusive sekundärer Infektion oder Thrombosen (diese traten nur im Placeboarm auf; 12,5 %) kam es sogar seltener als unter Placebo. Die Ergebnisse können sich durchaus sehen lassen, erst größere Patientenzahlen in Phase-III werden aber genauere Aussagen zulassen. (7)
Quellen:
1 Ann Rheum Dis 2021; 80(Suppl1): 2-4 (OP0006)
2 Ann Rheum Dis 2021; doi: 10.1136/annrheumdis-2021-220418
3 Ann Rheum Dis 2021; 80(Suppl1): 171-172 (OP0283)
4 Ann Rheum Dis 2021; 80(Suppl1): 199-200 (LB0002)
5 Ann Rheum Dis 2021; 80(Suppl1): 200-201 (LB0003)
6 Ann Rheum Dis 2021; doi: 10.1136/annrheumdis-2021-220647
7 Ann Rheum Dis 2021; 80(Suppl1): 198-199 (LB0001)