Über Neuigkeiten bei SLE und LN berichtete Prof. Dr. Martin Kriegel, Münster, der zunächst die SAV3E-„Basics“ (Sonnenschutz, Antimalariamittel, Vitamin D, Vakzinierung, vaskuläres Risikomanagement, Evaluation der Organbeteiligung) betonte. Die SLE-Therapie erfolgt nach dem Schweregrad, wichtige Aspekte des in Mailand vorgestellten Updates der EULAR-Empfehlungen sind eine niedrigere Glukokortikoid (GK)-Erhaltungsdosis von 5 statt 7,5 mg/Tag (in Kombination mit Hydroxychloroquin, HCQ) sowie die Gleichstellung der bDMARDs Belimumab und Anifrolumab mit Immunsuppressiva mit dem Ziel, diese eher früher im Verlauf einzusetzen (bei Versagen der Standardtherapie aus HCQ und GK oder zu hohen GK-Dosen).
Bei aktiver LN „entfällt“ mit Belimumab und Voclosporin die klare Unterteilung in Induktions- und Erhaltungstherapie. Bei extra-renalem SLE scheint Anifrolumab vor allem bei schwerem Hautbefall gut wirksam zu sein, eine Phase-III-Studie prüft derzeit eine s.c.-Applikation (120 mg/Woche), eine weitere Phase-III-Studie (IRIS) dessen Anwendung (i.v. 900 mg für 3 Dosen, dann i.v. 300 mg) bei aktiver LN. Ein weiterer Aspirant bei LN ist der Anti-CD20-Antikörper Obinutuzumab, der derzeit ebenfalls in einer Phase-III-Studie (REGENCY) geprüft wird.
Immuntherapien bei SLE und LN im Fokus
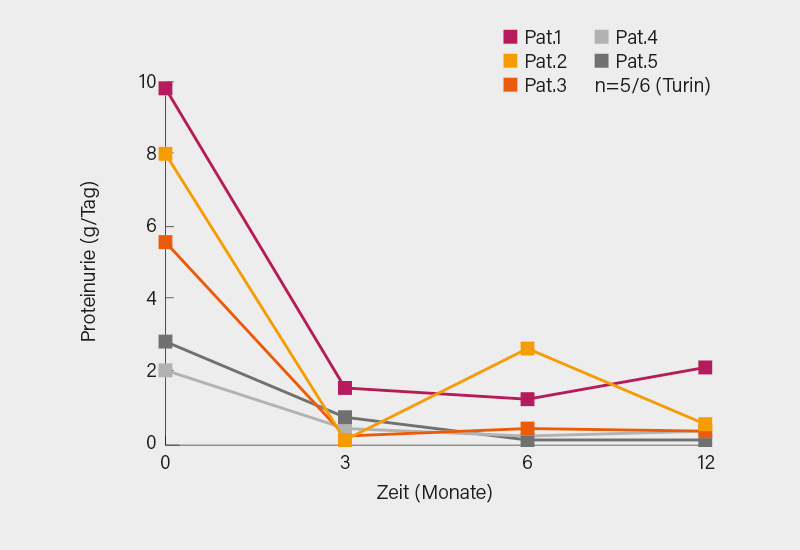
Bei therapierefraktären LN-Patienten wurden inzwischen mit dem Anti-CD38-Antikörper Daratumumab gute Ergebnisse erzielt, so unisono Kriegel und Dr. Tobias Alexander, Berlin, der diesbezügliche Resultate auf einer den Kongress eröffnenden Plenarsitzung zu neuen Immuntherapien darlegte. Nachdem bereits in der Charité bei zwei austherapierten LN-Patienten ein überaus gutes Therapieergebnis erzielt wurde, veröffentlichte jetzt eine italienische Studiengruppe ebenso positive Erfahrungen zu 6 therapieresistenten SLE-Patienten mit LN, von denen 5 einen deutlichen Rückgang der Proteinurie erzielten (Nat Med 2023; 29(8): 2041-2047) (Abb.).
Diskutiert wurde auch die Möglichkeit, Daratumumab vor einem kompletten „Reset“ des Immunsystems in Form der CD19 CAR-T-Zell-Therapie zu erproben. Wie Dr. Jule Taubmann, Erlangen, darlegte wurden bei SLE und anderen Kollagenosen allein in diesem Zentrum mittlerweile 15 Patienten mit gutem Erfolg dieser Prozedur unterzogen. Inzwischen liegen für 5 SLE-Patientinnen (alle mit LN) Langzeitdaten über 24 Monate vor. Alle befinden sich seitdem unverändert in einer medikamentenfreien Remission (SLEDAI 2K =0) mit Serokonversion (dsDNA-Antikörper nicht mehr nachweisbar, Normalisierung des Komplementverbrauchs) und starkem Rückgang der Proteinurie. Schwere Infektionen (trotz COVID-19-Pandemie) blieben aus, ebenso kam es in den Tagen nach der Intervention nicht zu einem schweren Zytokinfreisetzungs-Syndrom.
PSS: Zwei Wirkstoffe in Phase-III-Studien
Obwohl es sich beim Sjögren-Syndrom, das demnächst womöglich in Sjögren-Erkrankung umgetauft wird, um die häufigste Kollagenose handelt, ist das Wissen hierzu relativ gering, erläuterte Prof. Dr. Diana Ernst, Hannover. Bezüglich der häufigen Sicca-Symptomatik wies sie darauf hin, dass sich diese auch vaginal manifestieren kann, weshalb ein Screening in der gynäkologischen Praxis sinnvoll sein kann. Neue Erkenntnisse gibt es zur Pathogenese: So ist eine genetische Prädisposition evident, auch eine Interferon (IFN)-Signatur, die mit SSA/SSB-Antikörpern assoziiert ist, scheint eine relevante Rolle zu spielen. Auch gibt es Fortschritte bei der Charakterisierung individueller Phänotypen aus Clusteranalysen, die künftig noch bessere Aussagen zum Lymphom- oder kardiovaskulären Risiko erlauben. Bei den Outcome-Scores könnte in klinischen Studien der „Patient Acceptable Symptom State“ (PASS) eine Alternative zum ESSPR bieten, ebenso der „Composite of relevant Endpoints for Sjögrens Syndrome“ (CRESS) oder das „Sjögrens Tool for Assessing Response“ (STAR) zum ESSDAI.
Für die systemische Therapie des PSS bieten die EULAR-Empfehlungen aus 2019 einen guten Leitfaden, mehrere neue Therapieansätze werden derzeit geprüft. Recht aussichtsreich erscheinen der Anti-CD40-Antikörper Iscalimab, der ebenso wie der gegen den BAFF-Rezeptor gerichtete Antikörper Ianalumab in Phase-III geprüft wird. Andere mögliche Optionen könnten eine Rituximab/Belimumab-Kombination oder auch der Bruton-Tyrosinkinase-Inhibitor Remibrutinib sein – angesichts der bisherigen Erfahrungen sollte man die Hoffnungen aber wohl nicht zu hoch schrauben.
SSc: Erste Erfolge mit CAR-T-Zellen
Bei der SSc besteht die klinische Problematik in einem sehr heterogenen Krankheitsverlauf, dem Fehlen einer gut etablierten Messung der Krankheitsaktivität und einer entsprechend schwierigen Therapiesteuerung, so Prof. Dr. Jörg Distler, Düsseldorf. Zur Identifizierung von Patienten mit besonders hohem Risiko für eine (Haut-)Progression bieten sich eine Anreicherung nach klinischen Parametern, neue Biomarker und ein Omics-basiertes Profiling an.
Ersteres gelang recht gut in den Phase-II- und -III-Studien zu Tocilizumab (frühe, schwere diffus-kutane SSc mit ausgeprägter Entzündung, vorherige Progression der Hautfibrose) – dies jedoch primär in Bezug auf die ILD und weniger auf die Haut. Eine Visualisierung (und Bestimmung) der molekularen Fibroseaktivität ist mittels 68Ga-FAPI-04 PET-CT möglich. Auch die ex-vitro-Evaluation direkt im Patientengewebe – in ultradünnen Hautschnitten – zur Prädiktion des klinischen (über das molekulare) Therapieansprechen z. B. auf Mycophenolat Mofetil (MMF) ist eine mögliche Option – beides ist aber noch weit von der klinischen Praxis entfernt. An neuen Therapiekandidaten mit unterschiedlichen Wirkprinzipien herrscht kein Mangel, inwieweit und ob diese überhaupt in klinischen Studien bestehen, bleibt abzuwarten.
Bereits greifbar ist bei therapierefraktären Patienten die Möglichkeit eines Neustarts des Immunsystems mit Verlust der Autoimmunität. Dass die CAR-T-Zell-Therapie auch beim SSc funktioniert, verdeutlichte Distler an einem Patientenbeispiel, wo 3 Monate nach der Intervention eine sehr deutliche Verbesserung des EUSTAR-Aktivitätsindex und modifizierten Rodnan Skin-Scores eintrat. Wie PD Dr. Wolfgang Merkt, Heidelberg, zuvor auf einer Plenarsitzung anhand eines eigenen ersten SSc-Falls, der mit CAR-T-Zellen der 3. Generation behandelt wurde, schilderte, scheint bis zur Resolution der ILD etwas mehr Geduld gefragt zu sein; auch wurde hier im Unterschied zum SLE in der Folge mit MMF und Nintedanib (weiter)behandelt.
IIM: Immuntherapien auch hier eine Option
Bei der heterogenen Gruppe der IIM muss man sich laut Prof. Dr. Ina Kötter, auf Neuerungen bezüglich der Nomenklatur einstellen. So dürfte z. B. die häufig diagnostizierte, aber sehr seltene Polymyositis (PM) als eigenständige IIM-Unterform entfallen, klinisch ist sie identisch mit der nekrotisierenden Myopathie (=IMNM). Am häufigsten ist die Dermatomyositis (DM), mit klinischen Unterschieden zwischen den Subgruppen (Anti-TIF1, Anti-MDA5, Anti-Mi2).
Die Organbeteiligung und damit die Prognose ist mit dem Antikörperprofil assoziiert, wichtige Beispiele sind die Anti-MDA5-positive DM und das Antisynthetase-Syndrom (ASS). Eher neu ist die Erkenntnis, dass Anti-Ro52 bei IIM-assoziierter ILD mit einer schlechteren Prognose (vor allem im Verbund mit Anti-MDA5) verknüpft ist. Interessant ist ferner, dass die Anti-HMGCR-assoziierte Myositis eher selten mit einer vorherigen Statin-Einnahme in Verbindung steht. Schon länger ist bekannt, dass das Risiko eines zugrundliegenden Malignoms mit Antikörpern assoziiert ist, besonders problematisch sind Anti-TIF1g (CCAR- und Sp4-Antikörper scheinen dieses Risiko etwas abzuschwächen) und Anti-NXP2 – ein Organscreening ist hier unerlässlich.
Eine frühzeitige Diagnose und Therapie sind vor allem bei einer assoziierten ILD essenziell – hier bietet sich mit Nintedanib eine antifibrotische Therapie an. Aus der RECITAL-Studie geht – auch in der Subgruppe mit IIM-ILD – hervor, dass Cyclophosphamid etwas wirksamer als Rituximab erscheint. Bei Anti-MDA5-positiver DM besteht in den ersten 3 Monaten nach der Diagnose ein hohes Pneumocystis jirovecii-Pneumonie (PjP)-Risiko, eine Cotrimoxazol-Prophylaxe wirkt prognoseverbessernd. Bei therapierefraktären IIM-Patienten gibt es vor allem im Kontext einer ILD mehrere positive Fallberichte zu Daratumumab und zur CD19 CAR-T-Zell-Therapie, so abschließend Kötter. Weitere (Langzeit-)Daten zu diesen experimentellen Therapien bleiben noch abzuwarten.
Quelle: Plenarsitzung „Innovative zielgerichtete Immuntherapien- quo vadis“,
30. August, Klinische Sitzung „Kollagenosen kompakt – Update 2023“, 31. August 2023