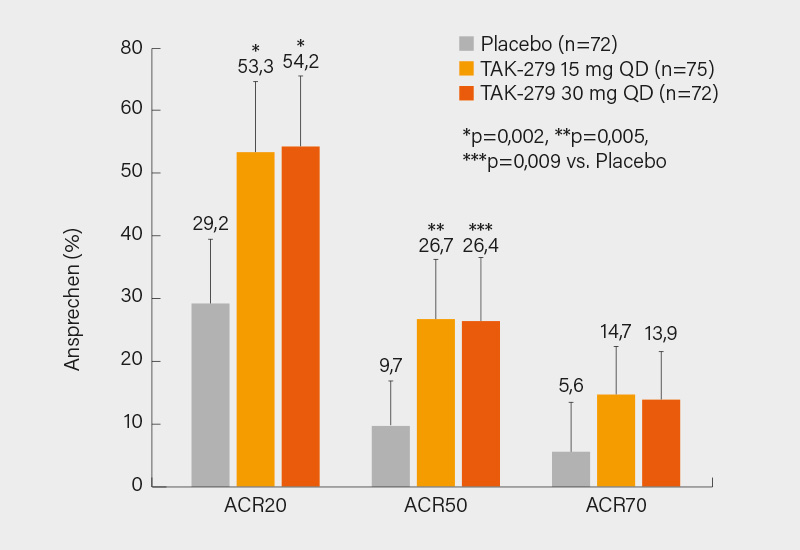
Der orale TYK-2-Inhibitor TAK-279 hatte kürzlich bei Psoriasis in einer Phase-IIb-Studie gute Ergebnisse geliefert. In San Diego wurden nun die Daten einer 12-wöchigen Studie bei PsA nachgelegt. In der multizentrischen Phase-IIb-Studie wurden 290 Patienten mit aktiver PsA trotz NSAR-, DMARD- oder Biologika-Vorbehandlung (Symptome für ≥6 Monate, die CASPAR-Kriterien erfüllend, SJC/TJC ≥3) im Verhältnis 1:1:1:1 für 12 Wochen auf 1x täglich TAK-279 5 mg (n=71), 15 mg (n=75), 30 mg oder Placebo (jeweils n=72) randomisiert. 245 schlossen die Studie ab (die Baseline-Charakteristika waren vergleichbar, außer niedrigerer TJC in 30 mg-Gruppe; 58,6 % mit Psoriasis ≥3 % KOF, PASI zu Baseline 6,2; 32,1 % bDMARD-erfahren [20,7 % TNFi]; Baseline-hsCRP 7,0 mg/l, 45,9 % mit hsCRP ≥3 mg/l). Primärer Endpunkt war das ACR20-Ansprechen zu Woche 12. Letzterer wurde mit TAK-279 15 mg und 30 mg gegenüber Placebo signifikant erreicht (53,3 und 54,2 vs. 29,2 %; je p=0,002). Dasselbe galt für das ACR50-Ansprechen (26,7 und 26,4 vs. 15,5 %; p=0,005 bzw. p=0,009), numerische Vorteile zeigten sich auch im ACR70 (Abb. 1). Das PASI 75-Ansprechen war am höchsten unter der 30 mg-Dosis (45,7 %) gegenüber den anderen Dosen (28,3 % [15 mg]; p=0,101) und Placebo (15,4 %; p=0,002). Bei guter Verträglichkeit fanden sich therapieassoziierte unerwünschte Ereignisse (TEAE) unter der 30 mg-Dosis häufiger (40,3 vs. 15,3 % unter Placebo), zum Abbruch führten sie aber selten (6,9 %). Am häufigsten kam es unter TAK-279 zu Nasopharyngitis, Infekten der oberen Atemwege, Kopfschmerzen und Ausschlägen, nicht aber zu schweren TEAE wie opportunistischen Infektionen oder schweren kardiovaskulären Ereignissen (MACE). Genaueres wird sich erst nach einer etwaigen Phase-III-Studie sagen lassen – auch ist das Feld bei der PsA bereits recht voll. (1)
Update zu Secukinumab und Izokibep
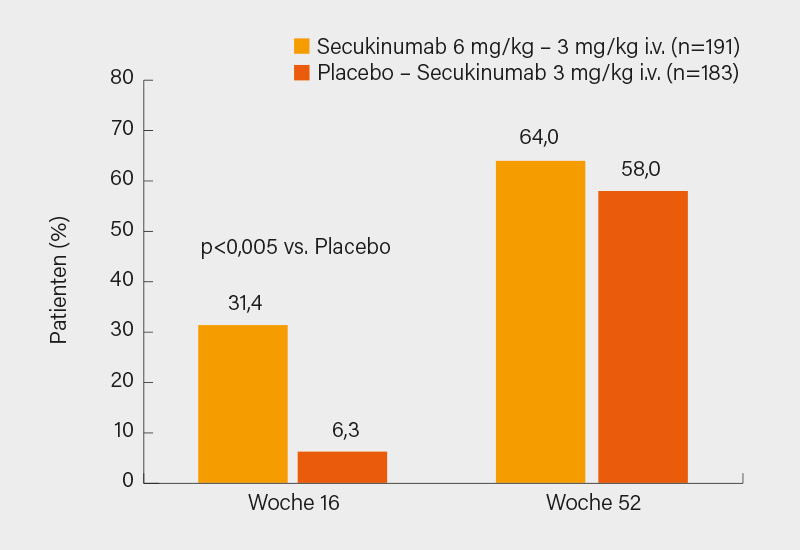
Ebenfalls ein Team um Alan J. Kivitz prüfte eine i.v.-Formulierung von Secukinumab bei PsA, die für einige ausgewählte Patienten eine sinnvolle Alternative sein könnte (obwohl, auch aus ärztlicher Sicht sicher weiterhin die s.c.-Applikation zu präferieren ist). In der randomisierten, doppelblinden, placebokontrollierten Phase-III-Parallelgruppen-Studie wurden 381 Patienten mit aktiver PsA gemäß den CASPAR-Kriterien (Symptome für ≥6 Monate, TJC78/SJC76 ≥3) im Verhältnis 1:1 auf i.v. Secukinumab (initial 6 mg/kg, dann 3 mg/kg alle 4 Wochen; n=191) oder Placebo (n=190) randomisiert. Zu Woche 16 wechselten oder blieben die Patienten auf i.v. Secukinumab 3 mg/kg Q4W bis Woche 52 (je ca. 90 % schlossen die Studie ab). Primärer Endpunkt war das ACR50-Ansprechen zu Woche 16, sekundäre Endpunkte u. a. eine minimale Krankheitsaktivität (MDA), der PASI 90 und die Resolution von Enthesitis bzw. Daktylitis.
Unter i.v. Secukinumab erreichten zu Woche 16 mehr Patienten ein ACR50-Ansprechen (NRI, 31,4 vs. 6,3 %; p<0,0001), ab Woche 20 stieg dieses auch in der darauf umgestellten Gruppe rasch an und resultierte zu Woche 52 in vergleichbaren Ansprechraten (as observed, Secukinumab, 58,0 %; Placebo/Secukinumab 64,0 %) (Abb. 2). Ebenso schnitt die neue i.v.-Formulierung zu Woche 16 in den sekundären Endpunkten signifikant besser ab und nach 52 Wochen waren die Outcomes dann vergleichbar (z. B. je ca. 54 % mit MDA, 80 bzw. 78 % mit PASI 90, 90 und 87 % bzw. 78 und 76 % ohne Daktylitis respektive Enthesitis). Bis Woche 16 wurden keine relevanten Unterschiede bezüglich aller/schwerer AE verzeichnet, bis Woche 52 kam es unter i.v. Secukinumab bei 63,4, 5,9 und 1,9 % der Patienten zu jedweden, schweren bzw. zu einem Abbruch führenden AE. Die i.v.-Therapie war somit effektiv und verträglich, eine Zulassung seitens der FDA ist bereits erfolgt. (2)
Kurz erwähnt sei an dieser Stelle Izokibep, ein neuartiger niedermolekularer IL-17A-Inhibitor, der auf dem EULAR 2022 mit spektakulären 16-Wochen-Daten einer Phase-II-Studie von sich reden machte. Philip J. Mease, Seattle (USA), und Kollegen stellten jetzt die Daten von 59 Patienten auf Izokibep 80 mg Q2W (kontinuierlich oder ab Woche 16) vor, die bei Studienende ein Follow-up von 46 Wochen erreicht hatten. 65 bzw. 71 % erzielten ein ACR70-Ansprechen, 57 bzw. 67 % eine MDA, jeweils über 70 % einen PASI 100 und ca. 80 % eine Resolution der Enthesitis. Angesichts einer sehr guten Verträglichkeit wird in einer laufenden Phase-IIb/III-Studie auch eine 160 mg-Dosis getestet, mit deren Ergebnissen ist Ende 2024 zu rechnen. (3)
Ustekinumab übergangsweise mit MTX kombinieren
Häufig wird MTX bei aktiver PsA als First-line-DMARD-Therapie eingesetzt, dessen Nutzen (bei erforderlicher Eskalation) in Kombination mit bDMARDs ist aber sehr fraglich. In der deutschen Prüfer-initiierten, randomisierten, placebokontrollierten MUST-Studie war kürzlich bei 173 Patienten mit aktiver PsA (41 % Frauen, im Mittel 48 Jahre, SJC66 8, TJC68 12, DAS28-CRP 4,5, PASI 2,6, >50 % mit Enthesitis, >20 % mit Daktylitis) untersucht worden, ob Ustekinumab in Kombination mit MTX (entweder neu verordnet oder beibehalten, n=78) Vorteile gegenüber einer Ustekinumab-Monotherapie (plus Placebo, n=79) bietet. Weder für neu verordnetes noch weiter verabreichtes MTX war dabei ein Zusatznutzen gegeben. Jetzt warfen Michaela Köhm, Frankfurt/M., und Kollegen in einer neuen Analyse nochmal einen genaueren Blick darauf, ob bei neu eingeführtem Ustekinumab der Entzug von MTX das frühe Therapieansprechen (DAPSA, DAS28) in den ersten 16 Wochen beeinflusst.
Tatsächlich war in der Subgruppe mit MTX-Vortherapie (n=80) dessen Absetzen gegenüber der Fortführung mit einem selteneren Erreichen einer niedrigen Krankheitsaktivität (LDA) bzw. Remission im DAS28-CRP (21,6 vs. 25,6 %) und vor allem DAPSA (10,8 vs. 25,6 %) nach 4 Wochen assoziiert. Zu Woche 16 bzw. 24 hatten die Ansprechraten ohne oder mit MTX ein vergleichbares Niveau erreicht. Während insgesamt eine Kombination mit MTX also keinen Zusatznutzen hat, kann dessen temporäre Fortführung über bis zu 12 Wochen bei Neueinstellung auf Ustekinumab (bis dieses ausreichend wirkt) durchaus sinnvoll sein. (4)
Apremilast wirksam bei oligoartikulärer PsA
Trotz erheblicher Krankheitslast wurde die oligoartikuläre PsA oft stiefmütterlich behandelt. Mit der randomisierten, doppelblinden, placebokontrollierten Phase-IV-Studie FOREMOST wurde von Philip J. Mease, Seattle (USA), und internationalen Kollegen jetzt erstmals eine solche Studie in diesem Patientenkollektiv vorgelegt. 308 Patienten mit früher PsA (≤5 Jahre, im Mittel 10 Monate; Alter 51 Jahre, 40 % auf csDMARD) und limitierter Gelenkbeteiligung zu Baseline (TJC68 >1, aber ≤4, SJC66 ≤4) wurden im Verhältnis 2:1 für 24 Wochen auf Apremilast (n=203) oder Placebo (n=105) randomisiert mit „early escape“ in Woche 16. Primärer Endpunkt war der prozentuale Anteil von Patienten, die in Woche 16 einen modifizierte MDA-Gelenkscore erreichten (SJC ≤1 und TJC ≤1 sowie 3/5 Kriterien). Sekundäre Endpunkte waren eine cDAPSA-Remission (≤4) oder -LDA (>4 bis ≤13), globales Patientenurteil (PtGA) ≤20, Schmerzen (VAS) ≤15, gutes oder mäßiges PASDAS-Ansprechen und der PsAID-12.
Im Ergebnis erreichten 33,9 vs. 16,0 % der Patienten den primären MDA-Endpunkt in Woche 16 (p=0,0008). Signifikante Vorteile von Apremilast bestätigten sich auch in den sekundären Endpunkten. Insgesamt 87 % der Patienten hatten ≤4 aktive Gelenke zu Baseline. Eine Post-hoc-Analyse zeigte ein vergleichbares MDA-Gelenkansprechen bei Patienten mit 2-4 aktiven Gelenken zu Baseline (34,4 vs. 17,2 %) wie in der Gesamtpopulation. Nur im Placebo-Arm stieg in dieser Gruppe der Anteil von Patienten mit einem Progress zu >4 aktiven Gelenken bis Woche 16. Somit wurde eine bessere Krankheitskontrolle mit Apremilast nachgewiesen (5), ein aktiver MTX-Kontrollarm (bei csDMARD-naiven Patienten) wäre aber wünschenswert gewesen.
Quellen:
1 ACR Convergence 2023; Late Breaking-Poster L12
2 Arthritis Rheumatol 2023; 75 (Suppl 9): Abstr. 0776
3 Arthritis Rheumatol 2023; 75 (Suppl 9): Abstr. 1688
4 Arthritis Rheumatol 2023; 75 (Suppl 9): Abstr. 1440
5 Arthritis Rheumatol 2023; 75 (Suppl 9): Abstr. 1691