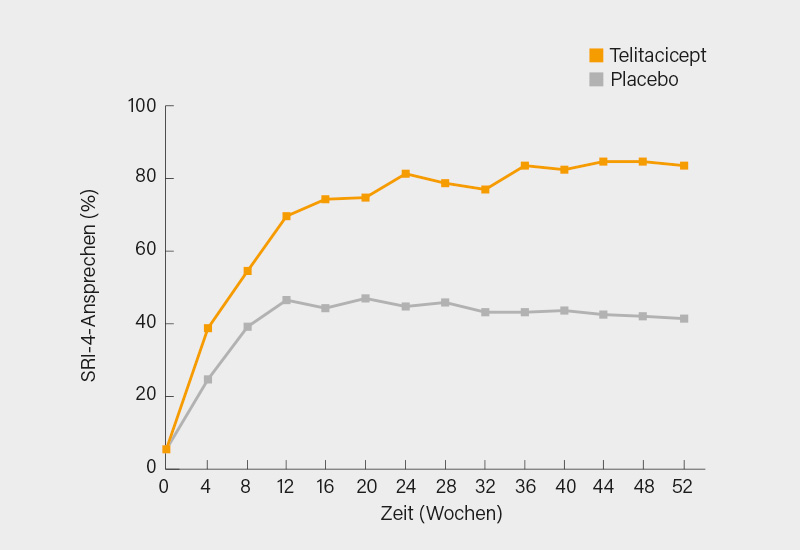
In der Phase-III-Studie zu dem TACI-Fc-Fusionsprotein Telitacicept, das in China bereits seit März 2021 für SLE zugelassen ist, wurden 335 ANA- und/oder anti-dsDNA-positive SLE-Patienten im Alter von 18-65 Jahren und einem SELENA-SLEDAI-Score ≥8 im Verhältnis 1:1 für 52 Wochen zusätzlich zu einer Standardtherapie auf 1x/Woche s.c. Telitacicept 160 mg oder Placebo randomisiert. 70,4 % der Patienten blieben bis Woche 52 in der Studie. Primärer Endpunkt war die SLE Responder Index (SRI)-4-Ansprechrate in Woche 52, definiert als ≥4 Punkte Reduktion ab Baseline im SELENA-SLEDAI-Score, kein neuer BILAG A- oder ≤2 neue BILAG B-Domänenscores gegenüber Baseline und keine Verschlechterung (Anstieg <0,30 Punkte von Baseline) im Physician’s Global Assessment (PGA).
Telitacicept überzeugt in chinesischerPhase-III-Studie
Der primäre Endpunkt wurde unter Telitacicept in Woche 52 signifikant gegenüber Placebo erreicht (82,6 vs. 38,1 %; p<0,001), dies auch nach Non-Responder-Imputation (67,1 vs. 32,7 %; p<0,001). Bereits ab Woche 4 wurde die Differenz signifikant und blieb es bis Woche 52 (p<0,01 für alle Zeitpunkte) (Abb. 1). Unter Telitacicept wurde zudem häufiger eine Reduktion des SELENA-SLEDAI-Scores um ≥4 Punkte erreicht (70,1 vs. 40,5 %). Auch im Arzturteil (PGA) waren deutliche Vorteile ersichtlich (84,4 vs. 56,0 %).
Therapieassoziierte unerwünschte Ereignisse (UE) waren häufiger unter Telitacicept (91,6 vs. 84,5 %), nicht aber schwere UE (7,2 vs. 14,3 %) und es gab keine Todesfälle. Die Rate der Infektionen und Infestationen betrug 65,3 vs. 60,1 % unter Placebo. Häufiger als unter Placebo kam es zu Infektionen der oberen Atemwege (42,5 vs. 32,7 %), Herpes Zoster (4,8 vs. 3,6 %) und Gastroenteritiden (5,4 vs. 3,0 %); schwere Infektionen (1,2 vs. 5,4 %) waren dafür seltener. (1) Die Wirksamkeit von Telitacicept war wie bereits in Phase-II gut, die Ergebnisse aus Phase-III (bei bislang relativ guter Verträglichkeit) sind beeindruckend. Eine internationale Phase-III-Studie, in der auch eine höhere Dosis (240 mg) getestet wird, wurde bereits initiiert und dürfte in einigen Jahren bessere Einblicke in dessen Potenzial gestatten.
Upadacitinib mit positiven Daten in Phase-II-Studie
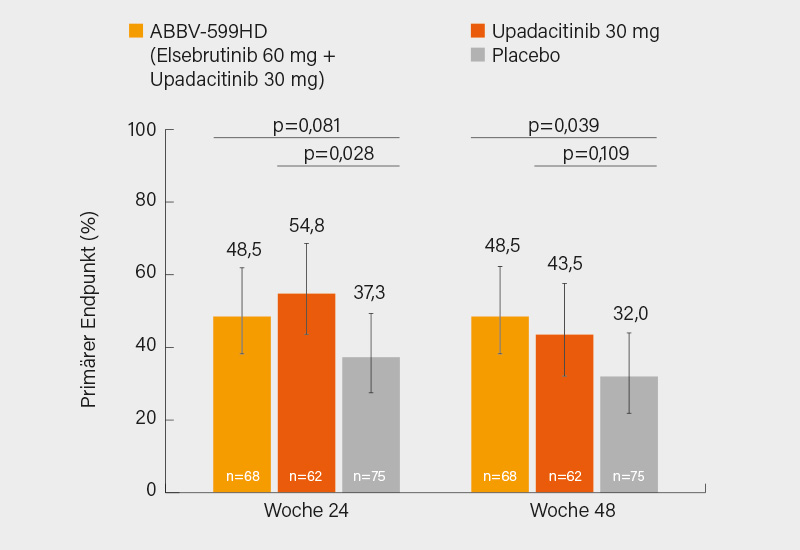
Ebenfalls in Phase-III soll der JAK-1-Inhibitor Upadacitinib geprüft werden. Basis hierfür sind die Ergebnisse der Phase-II-Studie SLek, in der 341 erwachsene Patienten mit mäßig bis schwer aktivem SLE im Verhältnis 1:1:1:1:1 auf 1x täglich (QD) ABBV-599 in hoher Dosis (HD; Elsubrutinib 60 mg plus Upadacitinib 30 mg), ABBV-599 in niedriger Dosis (LD; Elsubrutinib 60 mg plus Upadacitinib 15 mg), Elsubrutinib 60 mg, Upadacitinib 30 mg oder Placebo randomisiert wurden. Nach einer Interimsanalyse (50 % der Patienten hatten Woche 24 erreicht) wurden der ABBV-599 LD- und Elsubrutinib-Arm aufgrund Ineffektivität beendet. 205 Patienten setzten die Studie fort (ABBV-599 HD n=68, Upadacitinib 30 mg n=62 und Placebo n=75). Primärer Endpunkt war der Anteil von Patienten, die in Woche 24 ein SRI-4-Ansprechen und eine Steroiddosis ≤10 mg QD erreichten.
Der primäre Endpunkt in Woche 24 wurde sowohl von ABBV-599 HD (48,5 %) als auch Upadacitinib 30 mg (54,8 %) gegenüber Placebo (37,3 %) erreicht (p=0,081; p=0,028). In Woche 48 erreichten 48,5 und 43,5 vs. 32,0 % der Patienten diesen kombinierten Endpunkt (Abb. 2). Zumeist signifikante Vorteile von ABBV-599 HD und Upadacitinib 30 mg zeigten sich in Woche 48 auch in Bezug auf das Ansprechen im SRI-4 (51,5 und 45,2 % vs. 32,0 %) und BICLA (48,5 und 53,2 % vs. 25,3 %) und das Erreichen des LLDAS-Kriteriums für eine niedrige Krankheitsaktivität (39,7 und 50,0 vs. 24,0 %). Schübe und die Zeit bis zum ersten Schub (bis Woche 48) wurden jeweils substanziell reduziert. Therapieassoziierte UE wurden zu 42,6 (ABBV-599 HD) und 32,3 % (Upadacitinib 30 mg) vs. 33,3 % unter Placebo verzeichnet. Es gab keine neuen Sicherheitssignale, keine Malignitäten und keine VTE. (2) Als Fazit bleiben eine gute Wirksamkeit von Upadacitinib bei SLE, wobei der BTK-Inhibitor aber keinen Zusatznutzen brachte und eine weitere Exploration von ABBV-599 daher wohl keinen Sinn macht.
Ianalumab und Update zur CAR-T-Zell-Therapie
Nur als Poster von Josefina Cortés-Hernández, Barcelona (Spanien), präsentiert wurde eine 28-wöchige internationale randomisierte, doppelblinde, placebokontrollierte Parallelgruppen-Studie zu dem dual wirkenden, monoklonalen Anti- B cell Activating Factor of TNF Family (BAFF)-Rezeptor-Antikörper Ianalumab (der in Phase-II beim Sjögren-Syndrom überzeugte) und dem CD40-Antikörper Iscalimab. Dabei handelte es sich um zwei separate Kohorten mit 67 bzw. 40 SLE-Patienten mit einem SLEDAI-2K-Score ≥6 und BILAG-2004 ≥1 A oder 2 B-Scores (1:1-Randomisierung auf Verum oder Placebo). Berichtet wurden Interimsergebnisse zu s.c. Ianalumab 300 mg (n=34) vs. Placebo (n=33) in Woche 28 (mittleres Alter 40 Jahre, SLEDAI 2K 10, Prednison-Dosis zu Baseline 10 mg). Primärer Endpunkt waren ein SRI-4-Ansprechen in Woche 28 plus Prednison-Dosis ≤5 mg/Tag oder ≤ zu Baseline von Woche 16 bis 28. Diesen erreichten 44,1 vs. 9,1 % der Patienten, ein SRI-4-Ansprechen in Woche 28 70,6 vs. 24,2 %. Auch bei den sekundären Endpunkten wie der Schubrate und dem LLDAS zeigten sich klinisch relevante Vorteile von Ianalumab bei zugleich guter Verträglichkeit. (3) Eine weitere Exploration von Ianalumab in dieser Indikation wäre somit wünschenswert.
Nur kurz eingegangen – obwohl heiß diskutiert – sei auf die von Georg Schett, Erlangen, vorgestellten Daten zur langfristigen Sicherheit und Effektivität der CAR-T-Zelltherapie bei refraktärem SLE. Inzwischen liegen Erfahrungen zu sieben Patienten vor, die bis dato alle in eine anhaltende medikamentenfreie Remission (DORIS-Kriterien, LLDAS) gebracht wurden, die auch nach der B-Zell-Rekonstitution (längstes Follow-up: 22 Monate) bestehen blieb. (4)
Lupusnephritis: Baricitinib und Zetomipzomib im Fokus
Nachdem infolge der durchwachsenen bzw. diskrepanten Ergebnisse der Phase-III-Studie SLE BRAVE 1 und 2 der JAK-1/2-Inhibitor Baricitinib bei SLE wohl nicht weiterentwickelt wird, bot jetzt die von ägyptischen Rheumatologen um Manal Hassnien, Assiut, initiierte, aber recht kleine randomisierte „Phase-III-Studie“ mit Cyclophospamid (CYC) als aktivem Komparator eine überraschend gute Effektivität bei Lupusnephritis (LN). In dieser wurden 60 Patientinnen mit schwerer LN (Klasse III/IV, ausgeprägte Proteinurie) und einem SLEDAI-2K ≥4 im Verhältnis 1:1 auf Baricitinib 4 mg/Tag oder 1x/Monat i.v. CYC (0,7 mg/m2) randomisiert (plus Placebo-Tabletten bzw. -Infusionen). Den primären Endpunkt, eine Reduktion der Proteinurie um ≥50 %, erreichten in Woche 12 signifikant mehr Patientinnen unter Baricitinib als CYC (70 vs. 43 %; p<0,0001), auch in Woche 24 blieb dieser Vorteil erhalten (76,6 vs. 50,0 %). Auch bei anderen Endpunkten (C3, SLEDAI-2K) waren in Woche 12 und 24 Vorteile von Baricitinib (p<0,01) auszumachen, die Häufigkeit von UE war unter beiden Therapien vergleichbar. (5)
Kurz erwähnt sei noch die von Amit Saxena, New York (USA), als Poster präsentierte offene Phase-Ib/II-Studie MISSION, in der 21 Patienten mit einer aktiven LN (Klasse III/IV oder V) und Proteinurie zusätzlich zu einer Standardtherapie 1x/Woche s.c. 60 mg Zetomipzomib erhielten. Nach 24 Wochen fand sich bei 11 von 17 auswertbaren Patienten ein Rückgang der Proteinurie um ≥50 %, 6 erreichten ein vollständiges renales Ansprechen. (6) Weitere Daten zum tatsächlichen Potenzial dieses Immunproteasom-Inhibitors bleiben abzuwarten.
Quellen:
1 Ann Rheum Dis 2023; 82 (Suppl. 1): 90 (OP0137)
2 Ann Rheum Dis 2023; 82 (Suppl. 1): 91 (OP0139)
3 Ann Rheum Dis 2023; 82 (Suppl. 1): 275 (POS0120)
4 Ann Rheum Dis 2023; 82 (Suppl. 1): 93 (OP0141)
5 Ann Rheum Dis 2023; 82 (Suppl. 1): 34 (OP0053)
6 Ann Rheum Dis 2023; 82 (Suppl. 1): 891 (POS1128)