Axiale SpA: Neues zur Frühdiagnostik
Auf dem virtuellen ACR-Kongress wurden mehrere Abstracts präsentiert, die den Einsatz der KI bzw. des Machine-Learning (ML)-Ansatzes zur Verbesserung der axSpA-Diagnose (Frühdiagnose, Differenzialdiagnose) untersucht haben. Sengupta und Kollegen untersuchten eine KI-gestützte Identifizierung von Patienten mit axSpA auf Basis der Analyse der elektronischen Patientenakten in Großbritannien. Für die Entwicklung des ML-Algorithmus wurden Daten des britischen Clinical Practice Research Datalink (CPRD) benutzt. Der Algorithmus hatte die Aufgabe, auf der Grundlage früherer klinischer Indikatoren und der Krankengeschichte des Patienten die Wahrscheinlichkeit zu schätzen, dass bei einem Patienten eine axSpA diagnostiziert wird. (1)
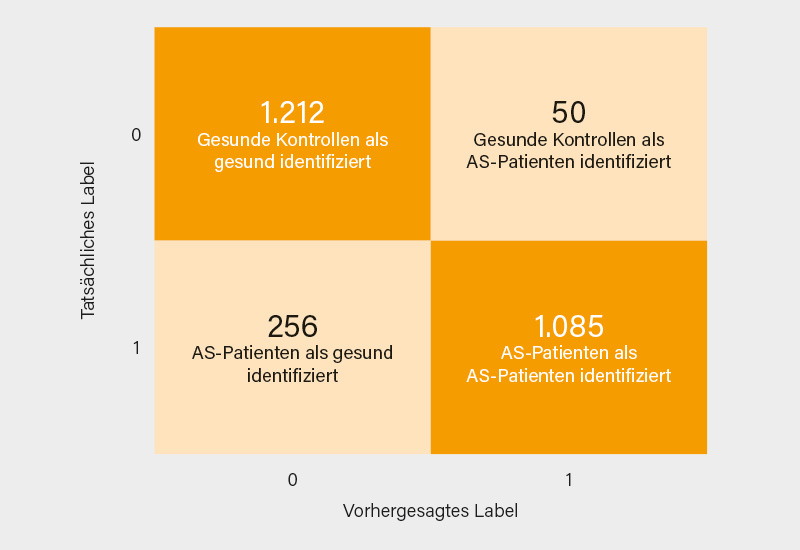
In die Studie wurden Patienten ≥18 Jahre aufgenommen, bei denen die Erstdiagnose von axSpA innerhalb des Identifizierungszeitraums (1.1.2005 bis 31.12.2018) erfolgte. Daten zur klinischen Präsentation, Überweisung, Untersuchung und Therapie wurden für jeden einzelnen Patienten vor der Diagnose einer axSpA extrahiert. Insgesamt wurden 5.090 Patienten mit axSpA und 5.089 gesunde Kontrollen (HC) eingeschlossen. Aus der Gesamtpopulation wurden 820 nutzbare ML-Merkmale abgeleitet. Der ML-Algorithmus führte zu einer hohen Genauigkeit (88,12 %), mit einer Präzision von 0,95 für Patienten mit axSpA und 0,83 für HC. Der Algorithmus identifizierte 89 klinische Prädiktoren (von 820 verwendeten), die zwischen Patienten und HC unterschieden, wie z. B. die Gesamtzahl der Tests, die Gesamtzahl der Überweisungen, das Alter bei der ersten Konsultation, das Alter bei der ersten Symptomatik und die Anzahl der Symptome bei Kreuzschmerzen. Die Sensitivität des Modells lag bei 75,04 % und der positive Vorhersagewert bei 80,88 %. Die Spezifität des Modells lag bei 0,96 und der negative prädiktive Wert bei 82,56 %. Insgesamt wies der ML-Algorithmus ein hohes Maß an Genauigkeit (88,12 %) und Präzision bei der Identifizierung möglicher Fälle von axSpA (0,95) auf (Abb. 1), was sich als nützlich erweisen könnte, um die Verzögerung bei der Diagnose zu verringern. Das Modell muss jedoch in der klinischen Routinepraxis noch weiter validiert werden. (1)
Axiale SpA: KI-Algorithmus für SIG-MRT
Bei der Diagnose und Differenzialdiagnose der axialen SpA spielt die Bildgebung der Sakroiliakalgelenke (SIG) eine große Rolle. Es laufen aktuell mehrere Initiativen zur Entwicklung von unterstützenden Instrumenten für die Erkennung SpA-typischer Veränderungen auf Röntgenbildern und in der Magnetresonanztomografie (MRT). In Berlin wird aktuell an einem KI-Algorithmus gearbeitet, der sowohl aktive entzündliche als auch strukturelle Veränderungen, die für eine axSpA typisch sind, erkennen soll – die ersten Ergebnisse wurden jetzt präsentiert. Zunächst werteten 6 geschulte und kalibrierte Reader MRT-Aufnahmen der SIG (semicoronale STIR) von 476 Patienten mit und ohne axSpA aus 4 Kohorten (GESPIC-AS, GESPIC-Crohn, GESPIC-Uveitis und OptiRef) aus. Die Leser gaben das Vorhandensein oder Nichtvorhandensein aktiver entzündlicher Veränderungen an, die mit axSpA vereinbar sind, und spezifizierten die Art der Veränderungen. Aktive entzündliche Veränderungen galten als vorhanden, wenn sie von mindestens 4 von 6 Lesern als positiv eingestuft wurden. Bilder mit unbestimmter Klassifizierung wurden in einer Konsenslesesitzung beurteilt. Diese Ergebnisse wurden für das Training und die Validierung des Algorithmus verwendet. MRTs aus der ASAS-Klassifizierungskohorte, die von 7 Lesern kommentiert wurden, bildeten den Holdout-Datensatz, der zur Prüfung der Generalisierbarkeit des neuronalen Netzwerks (CNN) verwendet wurde. (2)
Der trainierte Algorithmus erreichte eine Genauigkeit von 91,8 %, eine Sensitivität von 88,9 % und eine Spezifität von 93,5 % bei der Erkennung aktiver entzündlicher Veränderungen der SIG, die mit axSpA vereinbar sind, im Validierungsdatensatz. Die Genauigkeit der MRT-Klassifizierung in der unabhängigen Kohorte (ASAS) betrug 81,5 % mit einer Sensitivität von 67 % und einer Spezifität von 84,5 %. Die Studie zeigte somit die grundsätzliche Möglichkeit, mit der axSpA vereinbare pathologische Veränderungen in der MRT der SIG zu erkennen. Die Erkennung struktureller Veränderungen und die Interpretation der Befunde im Gesamtzusammenhang sind für die nachfolgenden Entwicklungsschritte gewährleistet. (2)
Maksymowych und Koautoren präsentierte eine neue daten-basierte Definition der entzündlichen Läsionen, die mit axSpA vereinbar sind. 8 Reader erfassten die MRT-Läsionen der Wirbelsäule von 62 Patienten aus der ASAS-Kohorte. Dabei wurde eine globale (Sind die Befunde auf diesem MRT-Scan mit axSpA vereinbar? ja/nein) und eine detaillierte Bewertung der Läsionen an allen Stellen der Wirbelsäule, einschließlich der Wirbelkörper sowie der lateralen und posterioren Elemente, abgegeben. Es wurde die Sensitivität und Spezifität für die Anzahl der Wirbelecken mit Knochenmarködem bestimmt, bei denen eine Mehrheit der Leser (>5/8) dem Vorhandensein von MRT-Befunden zustimmte, die auf eine axSpA hindeuten. Sowohl eine Spezifität von ≥95 % als auch ein positiver prädiktiver Wert von ≥95 % für die rheumatologische Diagnose wurden als Voraussetzungen für die vorläufige Festlegung von MRT-Cut-offs angesehen, die eine positive Wirbelsäulen-MRT definieren, die mit einer axSpA übereinstimmt. Ein Cut-off von Knochenmarködem in ≥4 Wirbelecken oder ≥3 Ecken bei zusätzlichen entzündlichen Läsionen an anderen Stellen oder Fettecken waren primäre Kandidaten für die Definition einer positiven MRT der Wirbelsäule, die mit axSpA vereinbar ist. (3)
Axiale SpA: Deeskalation von TNFα-Inhibitoren
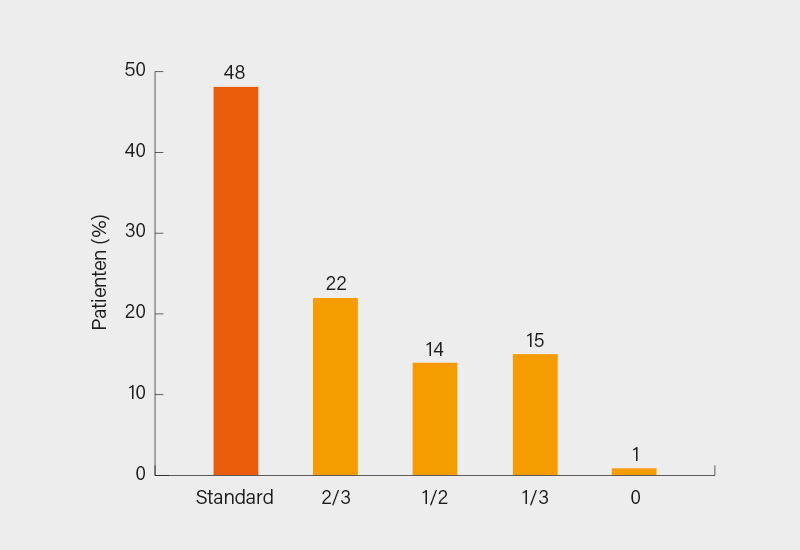
Wetterslev und Kollegen untersuchten in einer Studie aus Dänemark die Möglichkeiten einer Dosisreduktion von TNFα-Inhibitoren (TNFi) sowie die Prädiktoren einer Verschlechterung (eines Schubes) bei axSpA-Patienten. 109 Teilnehmer, davon 78 (72 %) mit Standarddosis und 31 (28 %) mit reduzierter Dosis zu Baseline, in klinischer Remission mit BASDAI <40, einem Arzt-Global-Score <40 und keinen Anzeichen von Krankheitsaktivität im Vorjahr, verringerten die TNFi-Dosis auf 2/3 der Standarddosis bei Studienbeginn, 1/2 in Woche 16, 1/3 in Woche 32 und setzten sie in Woche 48 ab. Die Patienten wurden bis zu 2 Jahre nachverfolgt. Bei Patienten, bei denen ein klinischer, BASDAI- (Verschlechterung ≥20 und absoluter Wert ≥40) oder MRT-Schub (≥2 neue oder verschlechterte Läsionen in der MRT der Wirbelsäule und/oder SIG) auftrat, wurde die Dosisreduktion abgebrochen und die Dosis auf die vorherige erhöht. Von den 106 Patienten, die die 2-Jahres-Follow-up-Phase abschlossen, war bei 55 (52 %) eine Dosisreduktion möglich (Abb. 2): 23 Patienten (22 %) erhielten eine 2/3-Dosis, 15 (14 %) eine 1/2-Dosis, 16 (15 %) eine 1/3-Dosis und 1 (1 %) brach die Behandlung ab. Gleichzeitig kam es bei 106 Patienten (von 107, die den Dosisreduktions-Algorithmus 2 Jahre lang befolgten) zu einem Schub: 30 (28 %) hatten einen Schub bei 2/3 der Standarddosis, 20 (19 %) bei 1/2, 29 (27 %) bei 1/3 und 27 (25 %) nach Absetzen des TNFi.
Bei Patienten, die zu Beginn der Studie eine Standarddosis erhielten, war eine niedrigere Beurteilung der Krankheitsaktivität durch den Arzt (PhGA) der einzige unabhängige Prädiktor für eine erfolgreiche Dosisreduktion (Odds ratio, OR 0,79; 95% KI 0,64-0,93). Nach 2 Jahren befanden sich 97 % der Patienten in klinischer Remission. Bei den bildgebenden Variablen wurden nur minimale Veränderungen beobachtet. Diese Studie zeigte, dass eine Dosisreduktion (aber kein Absetzen) der TNFi-Therapie in ca. 50 % der Fälle der axSpA möglich, dabei gab es keine zuverlässigen Prädiktoren dafür, bei wem und bei welcher Dosis ein Schub auftritt. (4, 5)
PsA: Kein erhöhtes kardiovaskuläres Risiko durch NSAR
Kardiovaskuläres Risiko und nichtsteroidale Antirheumatika (NSAR) ist ein umstrittenes Thema. Bei rheumatoider Arthritis und Arthrose scheinen NSAR mit einem erhöhten Risiko für ernsthafte kardiovaskulare (CV) Ereignisse (Herzinfarkt, Schlaganfall) assoziiert zu sein, bei der axSpA war dies nicht der Fall. Bei der Psoriasis-Arthritis (PsA) lagen hierzu bisher keine aufschlussreichen Daten vor. Kollegen aus Hongkong untersuchten den Einfluss des C-reaktiven Proteins (CRP) und der Einnahme von Medikamenten, inklusive NSAR, auf das Risiko von CV-Ereignissen unabhängig von traditionellen CV-Risikofaktoren bei Patienten mit PsA. Es wurde eine retrospektive Kohortenstudie bei 200 PsA-Patienten durchgeführt, die zwischen 2008 und 2015 rekrutiert und bis Ende 2019 nachverfolgt wurden. Endpunkt war das Auftreten eines ersten kardiovaskulären Ereignisses. Nach einer mittleren Nachbeobachtungszeit von 8,8 ±3,8 Jahren entwickelten 30 Patienten (15 %) ein erstes CV-Ereignis. Die Kaplan-Meier-Überlebenskurve und der Log-Rank-Test zeigten einen signifikanten Unterschied im ereignisfreien Überleben zwischen Patienten mit und ohne CRP-Erhöhung (>3 mg/L) und eine inverse Assoziation zwischen zeitlich variierender NSAR-Einnahme und ereignisfreiem Überleben. Das multivariable Cox-Regressionsmodell zeigte, dass der CRP-Spiegel (Hazard ratio, HR 1,02; 95% KI 1,00-1,04) und die NSAR-Einnahme (HR 0,30; 95% KI 0,15-0,95) signifikant und unabhängig von sonstigen kardiovaskulären Risikofaktoren mit CV-Ereignissen assoziiert waren. Somit konnte gezeigt werden, dass eine erhöhte Entzündungslast, die sich in einem erhöhten CRP widerspiegelt, mit einem erhöhten Risiko für kardiovaskuläre Ereignisse verbunden ist, während das Risiko durch die Einnahme von NSAR bei PsA-Patienten signifikant reduziert wurde. (6)
PsA: Neue orale Therapieoption geprüft
Nachdem die Januskinase (JAK)-Inhibition mit zunächst Tofacitinib und danach Upadacitinib Einzug in die PsA-Therapie gehalten hat, wurden zuletzt auf dem EULAR 2021 ermutigende Phase-II-Daten zu dem Tyrosinkinase (TYK)-2-Inhibitor Deucravacitinib bei PsA vorgestellt. Auf dem ACR stellten nun Mease und Kollegen eine randomisierte, placebokontrollierte Phase-IIb-Studie zu dem oralen TYK-2/JAK-1-Inhibitor Brepocitinib vor. Insgesamt 218 erwachsene Patienten mit aktiver PsA und unzureichendem Ansprechen oder Intoleranz von NSAR bzw. DMARDs wurden im Verhältnis 2:2:1:2 für 16 Wochen auf 1x täglich Brepocitinib 60 mg, 30 mg, 10 mg oder Placebo randomisiert, danach erfolgte eine 1:1-Umstellung auf Brepocitinib 60 oder 30 mg bis Woche 52. Eine stabile csDMARD-Dosis und ein Anteil von <30 % Patienten mit TNFi-Vortherapie waren erlaubt.
Mit den beiden höheren Brepocitinib-Dosierungen wurde der primäre Endpunkt eines ACR20-Ansprechens in Woche 16 mit 66,7 % (30 mg) bzw. 74,6 % (60 mg) versus 43,3 % unter Placebo signifikant erreicht (p<0,05). Signifikante Vorteile der 30- und 60 mg-Dosierung in Woche 16 zeigten sich auch bezüglich der sekundären Endpunkte wie dem ACR50- (48,3 und 44,1 vs. 10,4 %) und ACR70-Ansprechen (26,7 und 23,7 vs. 0,7 %) sowie dem Erreichen einer minimalen Krankheitsaktivität (MDA: 35,0 und 35,6 vs. 3,0 %). Bei den Patienten mit auswertbaren Daten zum PASI wurden in Woche 16 auch signifikant höhere Ansprechraten gemäß PASI 75 (59,0 und 69,2 vs. 24,4 %) und PASI 90 (33,3 und 53,9 vs. 12,2 %) dokumentiert. Auch nach 52 Wochen blieb das Ansprechen erhalten oder steigerte sich noch. Bis Woche 16 zeigte sich ein akzeptables Sicherheitsprofil mit von JAK-Inhibitoren bekannten Nebenwirkungen wie Herpes Zoster und Laborwertveränderungen. Schwere kardiovaskuläre Ereignisse, venöse Thromboembolien oder Todesfälle traten nicht auf. Für eine genauere Bewertung bleiben weitere Studien abzuwarten. (7)
Neuer Therapieansatz bei SpA und PsA
Es wurde zudem ein neuer Therapieansatz vorgestellt, der in Zukunft bei Spondyloarthritiden einschließlich der axSpA und der PsA eine Rolle spielen könnte. Es handelt sich um einen Inhibitor von einem intrazellulären Enzym MK-2 (mitogen-activated protein kinase-activated protein kinase-2). Die Aktivierung von MK-2 erhöht die Stabilität und Translation der mRNA von proinflammatorischen Zytokinen (z. B. TNFα, IL-17, IL-6). Die Hemmung von MK-2 führt dagegen zur Reduktion der Produktion von proentzündlichen Zytokinen, was in präklinischen Studien gezeigt wurde. In einer randomisierten, placebokontrollierten Phase-I-Studie wurden 37 gesunde erwachsene Freiwillige mit einer 3:1-Randomisierung in 5 Dosisstufen von 10 bis 150 mg auf CC-99677 (MK2-Inhibitor) oder Placebo eingeteilt. Mehrfache Dosen von CC-99677 bis zu 150 mg über 14 Tage waren sicher und wurden von den gesunden Probanden in dieser Studie gut vertragen. In ex-vivo stimuliertem Blut von Probanden, die 14 Tage lang einmal täglich eine Dosis von mehr als 10 mg CC-99677 erhielten, wurde während des Dosierungszeitraums eine anhaltende Verringerung der Produktion von TNFα, IL-6 und anderen proinflammatorischen Zytokinen und Chemokinen beobachtet. Ob diese Veränderungen auch mit der Verringerung der entzündlichen Aktivität im Rahmen von entzündlichen immun-vermittelten Erkrankungen einhergehen, bleibt abzuwarten. Phase-II-Studien mit CC-99677 bei Patienten mit Spodyloarthritiden sind geplant. (8)
Prof. Dr. med. Denis Poddubnyy
Leiter der Rheumatologie am Campus Benjamin Franklin – Medizinische Klinik für Gastroenterologie, Infektiologie und Rheumatologie
Charité – Universitätsmedizin Berlin
Hindenburgdamm 30, 12203 Berlin
Quellen: 1 Sengupta R et al., Arthritis Rheumatol 2021; 73 (Suppl 10): Abstr. 1922 | 2 Poddubnyy D et al., Arthritis Rheumatol 2021; 73 (Suppl 10): Abstr. 0905 | 3 Maksymowych W et al., Arthritis Rheumatol 2021; 73 (Suppl 10): Abstr. 0904 | 4 Wetterslev M et al., Arthritis Rheumatol 2021; 73 (Suppl 10): Abstr. 0364 | 5 Wetterslev M et al., Arthritis Rheumatol 2021; 73 (Suppl 10): Abstr. 0929 | 6 Lam H et al., Arthritis Rheumatol 2021; 73 (Suppl 10): Abstr. 1920 | 7 Mease PJ et al., Arthritis Rheumatol 2021; 73 (Suppl 10): Abstr. 0488 | 8 Mensah K et al., Arthritis Rheumatol 2021; 73 (Suppl 10): Abstr. 0489