Die Hoffnungen, einer Dysbiose des Darmmikrobioms mit einer FMT (Stuhlimplantation) entgegenzuwirken und die Krankheitskontrolle zu verbessern, haben durch eine erste, von Maja Skov Kragsnaes, Odense (Dänemark), auf der Opening Plenary Abstract Session vorgestellte und bereits publizierte randomisierte, placebokontrollierte Proof-of-Concept-Studie bei PsA-Patienten einen erheblichen Dämpfer erhalten.
Stuhltransplantation ohne Wirknachweis
In der doppelblinden, auf Überlegenheit getrimmten Parallelgruppenstudie wurden im Verhältnis 1:1 (von 97 gescreenten) 31 erwachsene Patienten (2/3 Frauen, im Mittel 51 Jahre, mittlere Krankheitsdauer 4 Jahre) mit aktiver peripherer PsA (SJC ≥3) trotz einer Methotrexat (MTX)-Therapie entweder auf eine Gastroskopie-geleitete FMT oder Sham-Transplantation in das Duodenum (Dosierungen von 50 mg von vier gesunden Spendern) randomisiert. Die Sicherheit wurde während der gesamten Studienphase evaluiert, der primäre Wirksamkeitsendpunkt war der Anteil von Patienten mit Therapieversagen, definiert als erforderliche Therapieintensivierung bis Woche 26. Wichtige sekundäre Endpunkte waren die Veränderung im HAQ-DI und das ACR20-Ansprechen in Woche 26. Zwar wurden keine schweren unerwünschten Ereignisse (UE) berichtet (häufig waren gastrointestinale Ereignisse wie Übelkeit, Erbrechen, Flatulenzen), jedoch trat ein Therapieversagen häufiger in der FMT- als Sham-Gruppe auf (60 vs. 19 %, Hazard ratio, HR 4,87; 95% KI 1,31-18,18; p=0,018). Auch bezüglich der Verbesserung im HAQ-DI schnitt die Sham-Gruppe signifikant besser ab (0,07 vs. 0,30 Punkte; p=0,031). Hingegen war im ACR20-Ansprechen nach 26 Wochen kein Unterschied zwischen der FMT- und Sham-Therapie erkennbar (47 vs. 50 %; p=n.s.). In dieser ersten Studie zur FMT bei Patienten mit aktiver PsA war die FMT zwar sicher, aber der Sham-Therapie klar unterlegen. (1, 2) Ob das neue Verfahren bei PsA weiterverfolgt wird, bleibt abzuwarten.
Risankzumab: IL-23-Inhibitor besteht in Phase-III-Studien
Nach Guselkumab dürfte sich auch der selektive IL-23p19-Inhibitor Risankizumab bei PsA auf gutem Wege zu einer Zulassung befinden. Etwas versteckt als gewöhnlicher Abstract waren die 24-Wochen-Ergebnisse der von Lars Erik Kristensen, Kopenhagen (Dänemark), dargelegten internationalen, randomisierten, doppelblinden, placebokontrollierten Phase-III-Studie KEEPsAKE-1 zu dessen Effektivität und Sicherheit bei Patienten mit aktiver PsA (SJC und TJC ≥5) und unzureichendem Ansprechen oder Unverträglichkeit von ≥1 csDMARD zu finden. 964 Patienten (im Mittel Krankheitsdauer 7,1 Jahre, SJC 12,2, TJC 20,6; bei jenen mit ≥3 % von Psoriasis betroffener Körperoberfläche, BSA: im Mittel 16,7 %) wurden 1:1 auf s.c. Risankizumab 150 mg oder Placebo in Woche 0, 4 und 16 randomisiert. Primärer Endpunkt war das ACR20-Ansprechen in Woche 24. In einer sich anschließenden Open-label-Phase der noch laufenden Studie erhalten alle Patienten Risankizumab.
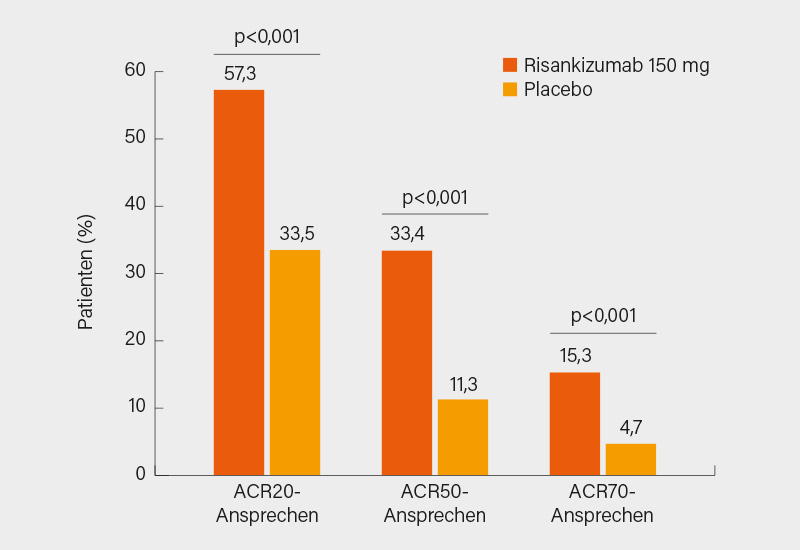
Im Ergebnis wurde der primäre ACR20-Endpunkt in Woche 24 signifikant erreicht (57,3 vs. 33,5 %; p<0,001), ein ACR50/70-Ansprechen fand sich bei 33,4 vs. 11,3 % bzw. 15,3 vs. 4,7 % (je p<0,001) (Abb. 1). Auch in den ersten 8 hierarchisch getesteten sekundären Endpunkten waren signifikante Vorteile in Woche 24 evident, so etwa im ΔHAQ-DI (-0,3 vs- 0,1), PASI 90-Ansprechen (52,3 vs. 9,9 %), Erreichen einer minimalen Krankheitsaktivität, MDA (25,0 vs. 10,2 %), Nagelpsoriasis im mNAPSI-Score (-9,8 vs. 5,6) und Resolution von Enthesitis (48,4 vs. 34,8 %) und Daktylitis (68,1 vs. 51,0 %) (je p<0,001). Schwere UE waren in beiden Armen vergleichbar (2,5 vs. 3,7 %), ebenso schwere Infektionen (1,0 vs. 1,2 %). (3)
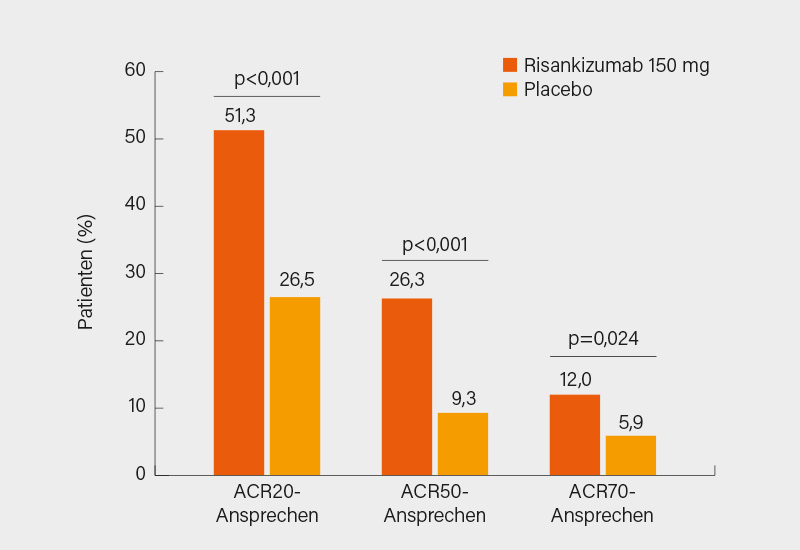
Die komplementäre, randomisierte, doppelblinde, placebokontrollierte Phase-III-Studie KEEPsAKE-2 stellte Andrew Ostor, Melbourne (Australien), vor. In dieser waren 443 Patienten mit aktiver PsA (SJC/TJC ≥5) und unzureichendem Ansprechen oder Unverträglichkeit von 1-2 bDMARDs (46,5 %) oder ≥1 csDMARD im Verhältnis 1:1 auf s.c. Risankizumab 150 mg oder Placebo in Woche 0, 4 und 16 randomisiert worden. Im Mittel hatten die Teilnehmer eine Krankheitsdauer von 8,2 Jahren, einen SJC von 13,3 und TJC von 22,6; bei jenen mit einer BSA ≥3 % betrug der durchschnittliche Wert 12,1 %. Der primäre Endpunkt eines ACR20-Ansprechens in Woche 24 wurde signifikant erreicht (51,3 vs. 26,5 %; p<0,001), das ACR50/70-Kriterium erfüllten 26,3 vs. 9,3 % (p<0,001) bzw. 12,0 vs. 5,9 %; p=0,024) (Abb. 2). Auch alle hierarchisch getesteten sekundäre Endpunkte wurden signifikant erreicht: ΔHAQ-DI -0,22 vs. -0,05, PASI 90-Ansprechen 55,0 vs. 10,2 %, MDA 25,5 vs. 11,4 %, ΔSF-36 PCS 5,9 vs. 2,0 (je p<0,001) und ΔFACIT-F 4,9 vs. 2,6 (p=0,009). Bei der Resolution von Enthesitis (42,9 vs. 30,4 %; p=0,009) und Daktylitis (72,5 vs. 42,1 %; p<0,001) in Woche 24 zeigte sich Risankizumab ebenfalls signifikant überlegen. Das Sicherheitsprofil war erneut gut mit schweren UE bei 4,0 vs. 5,5 % und schweren Infektionen bei 0,9 vs. 2,3 % der Patienten. Auch hier ist auf Langzeitdaten der noch andauernden Studie zu warten, um die Effektivität noch besser bewerten zu können. (4) Ähnlich wie Guselkumab scheint sich auch Risankizumab durch eine besonders gute Verträglichkeit auszuzeichnen, von einer späteren Zulassung ist auszugehen.
Neue Phase-III-Studie zu Guselkumab
Nachdem der bei PsA erste IL-23-Inhibitor Guselkumab bereits in den beiden Phase-III-Zulassungsstudien DISCOVER-1 und -2 überzeugt hatte, stellte nun Laura C Coates, Oxford (Großbritannien), die Ergebnisse der randomisierten, doppelblinden, placebokontrollierten Phase-IIIb-Studie COSMOS vor, in die (anders als in DISCOVER-1) primär TNF-erfahrene Patienten eingeschlossen wurden. Insgesamt 285 Patienten mit aktiver PsA (SJC und TJC ≥3) und Versagen auf oder Unverträglichkeit von 1-2 TNFα-Inhibitoren wurden im Verhältnis 2:1 auf s.c. Guselkumab 100 mg oder Placebo in Woche 0, 4 und dann alle 8 Wochen bis Woche 44 randomisiert mit Placebo-Crossover zu Guselkumab in Woche 24; bei <5 % Verbesserung im SJC und TJC war bereits ab Woche 16 ein „early espape“ (EE) auf Guselkumab gestattet. Im Mittel waren die Patienten 49 Jahre, die Krankheitsdauer betrug 8,5 Jahre, der SJC/TJC ca. 10 bzw. 20, 54 % waren Frauen, knapp 90 % hatten eine Anti-TNF-Vortherapie, die zu >80 % aufgrund Ineffektivität beendet wurde.
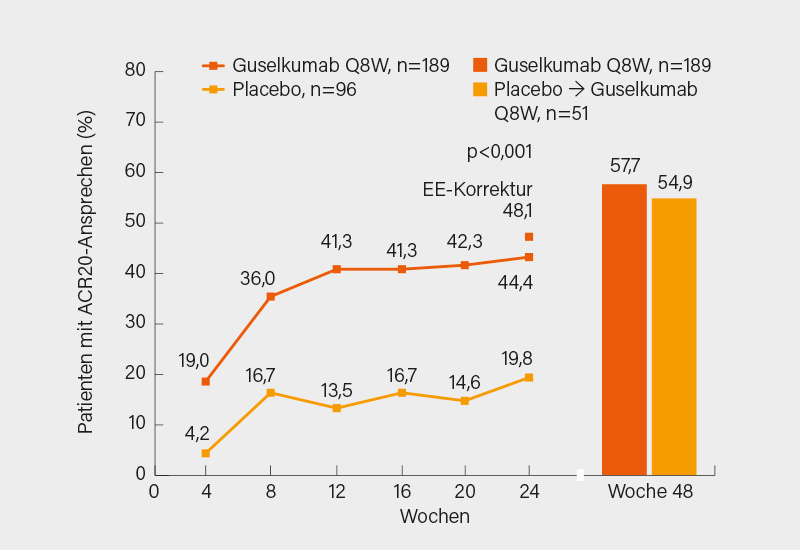
Den primären Endpunkt eines ACR20-Ansprechens in Woche 24 erreichten nach EE-Korrektur 48,1 vs. 19,8 % (Per-Protokoll 48,8 vs. 23,8 %) unter Guselkumab bzw. Placebo (p<0,001), bis Woche 48 stieg das Ansprechen auf 57,7 bzw. 54,9 % (kontinuierlich Guselkumab oder später darauf gewechselt) (Abb. 3). Das Ergebnis war konsistent in allen Subgruppen und unabhängig davon, ob die Anti-TNF-Vortherapie aufgrund Ineffektivität oder Unverträglichkeit beendet wurde. Signifikante Vorteile zeigten sich in Woche 24 nach EE-Korrektur auch im ΔHAQ-DI (-0,22 vs. -0,01; in Woche 48 bei durchgehender Guselkumab-Gabe -0,40), ΔSF-36 PCS (4,28 vs. -0,39; Woche 48 7,02), PASI 100-Ansprechen (33,8 vs. 3,8 %; Woche 48 53,4 %), ACR50 (21,2 vs. 5,2 %; Woche 48 39,2 %) und der Resolution von Enthesitis im Leeds Enthesitis Index (LEI) (39,7 vs. 18,8 %; Woche 48 55,6 %) und der Daktylitis (44,8 vs. 25,0 %; Woche 48 67,2 %). Bei guter Verträglichkeit erwies sich sich Guselkumab auch in diesem Patientenkollektiv als gut wirksam mit bei steigender Therapiedauer zunehmendem Wirkeffekt. (5)
Phase-II-Daten zu oralem TYK-2-Inhibitor
Mit dem selektiven TYK-2-Inhibitor Deucravacitinib, der an IL-23, IL-12 und Interferon a/b ansetzt , könnte sich künftig eine weitere orale Therapie in der PsA etablieren. Zunächst auf dem ACR 2020 präsentiert, stellte nun Philip J. Mease, Seattle (USA), die Ergebnisse einer randomisierten, doppelblinden, placebokontrollierten Phase-II-Studie zu Deucravacitinib bei aktiver PsA als Poster vor. In der 1-Jahres-Studie (placebokontrolliert bis Woche 16) wurden 203 Patienten mit aktiver PsA (SJC/TJC je ≥3, CRP ≥3 mg/l und ≥1 psoriatische Läsion ≥2 cm), die auf ≥1 NSAR, Steroid und/oder csDMARD oder einen TNFα-Inhibitor (≤30 %) versagt oder diese nicht vertragen hatten, im Verhältnis 1:1:1 auf Deucravacitinib 1x 6 oder 1x 12 mg/Tag oder Placebo randomisiert. Primärer Endpunkt war das ACR20-Ansprechen in Woche 16. 89 % der Teilnehmer (im Mittel 50 Jahre, Krankheitsdauer 4,5 Jahre, 66 % csDMARDs und 15 % mit vorheriger Anti-TNF-Therapie) schlossen die ersten 16 Wochen ab.
Sowohl unter Deucravacitinib 6 mg (n=70) als auch 12 mg (n=67) wurde mit 52,9 bzw. 62,7 vs. 31,8 % unter Placebo (n=66) signifikant häufiger der primäre Endpunkt eines ACR20-Ansprechens in Woche 16 erreicht. Im ACR50/70-Ansprechen zeigten sich gleichfalls signifikante Vorteile von Deucravacitinib (24,3 und 32,8 vs. 10,6 % bzw. 14,3 und 19,4 vs. 1,5 %) versus Placebo. Weder eine Anti-TNF-Vortherapie noch ein Körpergewicht < oder ≥90 kg nahmen relevanten Einfluss auf das Ansprechen auf Deucravacitinib. Im HAQ-DI-Ansprechen zeigten sich beide Dosierungen ebenso signifikant überlegen (38,6 und 40,3 vs. 15,2 %) wie im PASI 75-Ansprechen. Eine Resolution der Enthesitis (LEI) erreichten 51,3 und 50,0 vs. 22,6 % (je p<0,04), eine MDA 22,9 und 23,9 vs. 7,6 % (p<0,02). Die häufigsten UE, meist nur mild bis mäßig ausgeprägt, waren Nasopharyngitis, Kopfschmerzen, Sinusitis und Hautausschläge. Es wurden keine schweren UE wie schwere Infektionen, Herpes Zoster, opportunistische Infektionen oder thrombotische Ereignisse verzeichnet. (6, 7) Für eine genauere Bewertung bleiben die 1-Jahres-Daten abzuwarten – von einer Evaluation in Phase-III ist auszugehen.
Quellen:
1 Ann Rheum Dis 2021; 80(Suppl1): 6 (OP0010)
2 Ann Rheum Dis 2021; doi: 10.1136/annrheumdis-2020-219511
3 Ann Rheum Dis 2021; 80(Suppl1): 1315-1316 (AB0559)
4 Ann Rheum Dis 2021; 80(Suppl1): 138-139 (OP0228)
5 Ann Rheum Dis 2021; 80(Suppl1): 140-141 (OP0230)
6 Ann Rheum Dis 2021; 80(Suppl1): 314-315 (POS0198)
7 Ann Rheum Dis 2021; 80(Suppl1): 137-138 (OP0227)