Das auch beim Sjögren-Syndrom aussichtsreiche Ianalumab wurde in einer multizentrischen Phase-II-Parallelgruppenstudie geprüft, vorgestellt wurden zunächst nur die Ergebnisse einer Interimsanalyse zu 67 Patienten mit moderatem bis schwerem aktivem SLE (ANA ≥1:80, ≥4 von 11 der 1997er ACR-Klassifikationskriterien erfüllend, mit einem SLEDAI-2K-Score ≥6 und ≥1 BILAG-2004 A- oder ≥2 B-Scores inklusive einer Aktivität in mukokutanen und/oder muskuloskelettalen Domänen), die die 28-wöchige verblindete Studienphase abgeschlossen haben. Diese waren im Verhältnis 1:1 auf s.c. 300 mg Ianalumab 1x monatlich (n=34) oder Placebo (n=33) randomisiert worden. Primärer 28-Wochen-Endpunkt war ein Komposit aus einem SLE Responder Index (SRI)-4-Ansprechen (Woche 28) in Kombination mit einem Predniso(lo)n-Tapering auf ≤5 mg/Tag oder ≤ die Baseline-Dosis zu Woche 16 und ein Verbleiben in diesem Bereich bis Woche 28. Sekundäre Endpunkte waren u. a. moderate bis schwere BILAG-2004 (≥1 A or ≥2 B)-Flares und der Lupus Low Disease Activity State (LLDAS).
Erste Daten zeigen hohes SRI-4-Ansprechen
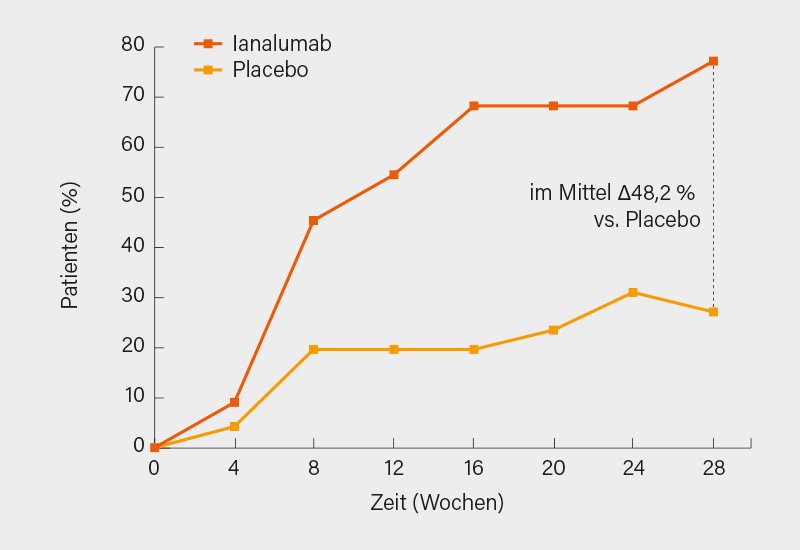
Ianalumab war sicher und wurde gut vertragen ohne therapieassoziierte Drop-outs oder schwere unerwünschte Ereignisse (SAE). Zu Baseline wurden im Ianalumab- und Placeboarm folgende medianen Baseline-Werte verzeichnet: SLEDAI-2K-Score 10 (6-32) vs. 10 (4-18) und Predniso(lo)n-Dosis 10 mg (0-30) vs. 10 mg (0-27,5). Bei allen mit dem BAFF-R-Inhibitor behandelten Patienten kam es zu einer markanten Depletion zirkulierender CD19+ B-Zellen (in Woche 28 median 1 Zelle/µl [0-3]). Unter Ianalumab wurde in Woche 28 ein SRI-4-Ansprechen von >70 % erreicht, die mittlere Therapiedifferenz gegenüber Placebo (n=24 vs. 8) betrug 48,2 % (90% KI 30,2-64,7) (Abb.), auch der primäre Komposit-Endpunkt wurde erreicht (von fast 45 %), entsprechend einer mittleren Therapiedifferenz vs. Placebo von 34,5 % (90% KI 19,2-49,4). Überdies fand sich unter Ianalumab eine geringere Rate moderater bis schwerer Flares (44 vs. 64 %), ebenso war die Zeit bis zum Flare länger. Auch wurde häufiger ein LLDAS erreicht. Des Weiteren kam es unter Ianalumab zu einem Rückgang von Anti-dsDNA- und Anti-C1q-Antikörpertitern sowie Anstieg der C3/C4-Komplementspiegel. Diese vorläufigen Ergebnisse können sich durchaus sehen lassen: Ein gutes SRI-4-Ansprechen, dies auch in Kombination mit einer anhaltenden Steroidreduktion, eine ausgeprägte B-Zell-Depletion sowie Verbesserung von Markern der Autoimmunität bei bislang guter Verträglichkeit. Die vollständigen Phase-II-Daten bleiben noch abzuwarten, ein Phase-III-Studienprogramm (SIRIUS-SLE 1 & 2 und SIRIUS-LN) wurde bereits initiiert. (1)
Weitere Neuigkeiten bei SLE und Lupusnephritis
Nur kurz eingegangen sei auf eine Reihe weiterer Studien. So stellten April Jorge, Boston (USA), und Kollegen eine emulierte Zielpunktstudie mit Propensity Score (PS)-Matching zu den Effekten oraler Antidiabetika – SGLT2- und DPP4-Inhibitoren – bei insgesamt 96.511 SLE- und Lupusnephritis (LN)-Patienten (im Mittel 57 Jahre, 89 % Frauen, 35 % chronische Niereninsuffizienz) vor. In der Kohorte fanden sich 426 bzw. 865 Anwender von SGLT2- und DPP4-Inhibitoren, darunter 154 bzw. 270 mit LN. Wie nach früheren Daten zu erwarten, waren SGLT2- gegenüber DPP4-Inhibitoren Inhibitoren mit einem signifikant geringeren Risiko für schwere kardiovaskuläre Ereignisse (MACE; Hazard Ratio, HR 0,69) und renale Progression (HR 0,71) assoziiert. In der LN-Subgruppe traf dies nur auf MACE zu (HR 0,58), bei der renalen Progression zeigten sich numerische Vorteile. Eine prospektive Studie zu SGLT2-Inhibitoren bei SLE sowie LN wäre weiter wünschenswert. (2)
Heißester Kandidat bei LN ist sicherlich der neue Anti-CD20-Antikörper Obinutuzumab, erste Phase-III-Daten der REGENCY-Studie könnten Ende nächsten Jahres anstehen, auf jene der Phase-III-Studie ALLEGORY beim SLE muss noch bis 2025 gewartet werden. Derweil gibt es erste Hinweise aus der von Kenneth Kalunian, San Diego (USA), und Kollegen präsentierten klinischen Phase-Ib-Studie EQUALISE, dass auch der Anti-CD6-Rezeptor-Antikörper Itolizumab (s.c. 1,6 mg/kg Q2W) bei aktiver, proliferativer LN effektiv sein könnte. Daten zu 17 LN-Patienten weisen auf ein in Kombination mit MMF und Steroiden gutes renales Gesamtansprechen (83 % in Woche 36) und eine mediane Reduktion des Urin-Protein/Kreatinin-Ratio um 72 % hin. Auf eine weitere Exploration ist zu hoffen. (3) Weiter positive Langzeitremissions- und Sicherheitsdaten zur CAR-T-Zell-Therapie präsentierten Georg Schett, Erlangen, und Kollegen – auch ein Erhalt der Impftiter wurde belegt. (4) Eine spanische Phase-I/II-Studie, die Giulio Cavalli, Basel (Schweiz), vorstellte, untersuchte jetzt mit YTB323 eine schnell herzustellende CAR-T-Zell-Therapie. Den präliminären Daten zufolge war das Verfahren sicher und lieferte bislang gute Therapieergebnisse bei 3 schwer refraktären SLE-Patienten (darunter 2 mit LN) – weitere (Langzeit-)Daten hierzu bleiben abzuwarten. (5)
Zuletzt noch kurz zu einer von Fareeda Hosein, Princeton (USA), und Kollegen als Late Breaking-Abstract vorgestellten randomisierten, doppelblinden, placebokotrollierten Phase-Ib-Studie zu dem neuartigen oralen Toll-like-Rezeptor (TLR)-7/8-Inhibitor Afimetoran. Dieser zeigte bei 13 Patienten mit kutanem LE (CLE) in einer Dosierung von 30 mg bei einem vorteilhaften Sicherheitsprofil eine frühe (ab Woche 4) und dann fortgesetzt bis Woche 16 anhaltende Reduktion des CLASI-A-Scores (-7,6 vs. -1,2). Eine weitere Exploration ist geplant, auch eine Phase-IIb-Studie bei SLE ist bereits angelaufen. (6)
Quellen:
1 Arthritis Rheumatol 2023; 75 (Suppl 9): Abstr. 2487
2 Arthritis Rheumatol 2023; 75 (Suppl 9): Abstr. 1579
3 Arthritis Rheumatol 2023; 75 (Suppl 9): Abstr. 1496
4 Arthritis Rheumatol 2023; 75 (Suppl 9): Abstr. 0607
5 ACR Convergence 2023; Late Breaking-Poster L13
6 ACR Convergence 2023; Late Breaking-Abstract L17