Pathogenese und Immunologie
Den Auftakt machte wie gewohnt Prof. Dr. Ulf Müller-Ladner, Bad Nauheim, der über das Themenfeld Pathogenese und Immunologie berichtete, so etwa über die potenziellen Effekte von COVID-19 auf die Entstehung von Autoimmunerkrankungen und das kürzlich entdeckte VEXAS-Syndrom. Auch wenn nicht unmittelbar praxisrelevant, sind doch neue Erkenntnisse zur womöglich nur vermeintlich „seronegativen“ rheumatoiden Arthritis (RA) von Interesse: So erhöhte bei Patienten mit ACPA-negativer RA das gemeinsame Vorliegen zweier anderer Autoantikörper (Anti-PTX3 und Anti-DUSP11) die diagnostische Treffsicherheit. In der Prä-RA wurden unabhängig vom ACPA-Status mit Toll-like-Rezeptor (TLR)-2, TNF und Interleukin (IL)-1 dominante Biomarker für die Entwicklung zur manifesten RA ausgemacht, die die Grundlage für künftige Therapiestudien zur Frühintervention mit TNFα-Inhibitoren (TNFi) oder IL-1-Rezeptorinhibitoren (IL-1Ri) bilden könnten.
Rheumatoide Arthritis
Mit Diagnostik und Komorbiditäten bei RA befasste sich Prof. Dr. Markus Gaubitz, Münster. Im Vorstadium der RA, bei klinisch verdächtiger Arthralgie (CSA), lohnt es sich offenbar im MRT nach einer intermetatarsalen Bursitis (IMB) zu suchen, prädiktiv für eine später zu diagnostizierende RA war deren Nachweis aber nur bei ACPA-positiven Patienten. Auch auf Tenosynovitis im MRT sollte geachtet werden – unabhängig vom ACPA-Status ist diese ein guter Marker für frühe RA. Bei CSA und früher RA zeigte zudem ganz klassisch ein positiver Gänsslen (MTP-Squeeze)-Test eine gute Korrelation mit IMB und Synovitis. Ein besonderes Augenmerk sollte bei CSA-„Patienten“ auf die Füße gelegt werden: Im Ultraschall erhöhten Knochenerosionen in ≥1 Gelenk drastisch die Wahrscheinlichkeit für die Progression zur RA.
Dass sich durch eine frühe Diagnosestellung und Therapie die Prognose der RA deutlich verbessern lässt, zeigen Daten der französischen ESPOIR-Kohorte: Nach 10 Jahren waren gut 50 % der Patienten in DAS28-Remission. Bei Patienten mit schwierig zu behandelnder, refraktärer RA, die kürzlich von der EULAR genauer definiert wurden (2), gilt es, die Diagnose kritisch zu hinterfragen und überprüfen, ob eine Entzündung als Ursache der Beschwerden objektivierbar ist (CRP, Ultraschall) und inwiefern Komorbiditäten darauf Einfluss nehmen. Eine wichtige Komorbidität auch bei der RA sind interstitielle Lungenerkrankungen (ILD). (1) Definitiv vom Tisch ist hier die Befürchtung, dass Methotrexat (MTX) eine ILD befördern kann. Weiterhin unklar ist, ob es eine MTX-Osteopathie gibt oder es sich um Stressfrakturen bei Risikopatienten handelt – letzteres dürfte wahrscheinlicher sein. Im osteologischen Kontext lesenswert sind auf jeden Fall die DGRh-Empfehlungen zur Glukokortikoid (GK)-induzierten Osteoporose. (3)
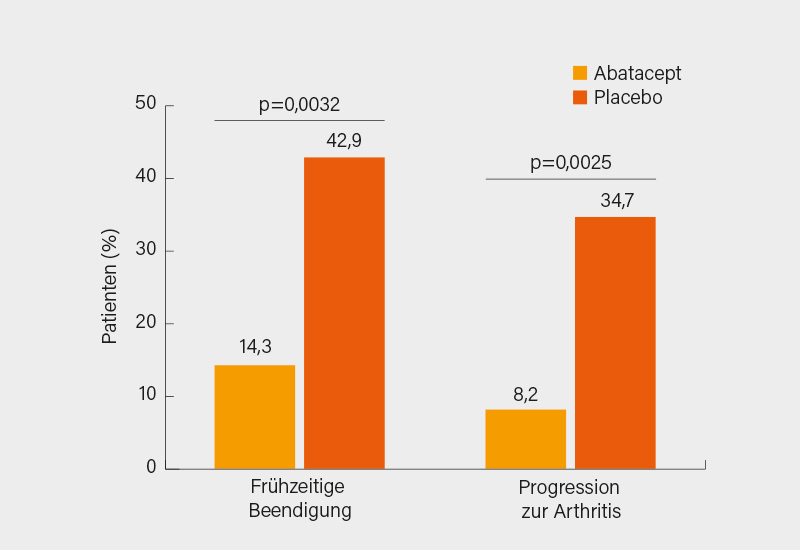
Im Anschluss gab Prof. Dr. Andrea Rubbert-Roth, St. Gallen (Schweiz), ein Update zur RA-Therapie. Nur kurz eingegangen sei auf die neuen ACR-Leitlinien (4), die sich im Gegensatz zur EULAR für orales MTX und (so möglich) gegen GK als Bestandteil der Starttherapie aussprechen, die aktuellen Daten zu Januskinase-Inhibitoren (JAKi) sind noch nicht berücksichtigt. Die Phase-IV Head-to-head-Studie Early AMPLE zeigte nach MTX-Versagen bei RF/ACPA- und Shared epitop-positiven Patienten ein besseres Ansprechen auf Abatacept gegenüber Adalimumab. Noch Zukunftsmusik ist ist die Prädiktion eines Therapieansprechens mittels Multiomics und Machine Learning – erste Ansätze sind aber vielversprechend. In der R4RA-Studie war in einer Subgruppe von B-Zell-armen RA-Patienten (die RNA-Sequenzierung war hierbei der Immunhistologie überlegen) ein besseres Ansprechen auf Tocilizumab versus Rituximab evident. Interessant war die deutsche ARIAA-Studie zum Einsatz von Abatacept bei Prä-RA, das gegenüber Placebo eine signifikante MRT-Verbesserung bei Patienten mit hohem Risiko für eine RA bot. Nach 6 Monaten wurde signifikant seltener eine RA diagnostiziert (Abb. 1).
Bei auf MTX versagenden Patienten schnitt die Triple-Therapie gegenüber der Eskalation auf bDMARDs gar nicht schlecht ab, jedoch war die Dropout-Rate höher. In puncto MTX belegt eine Analyse, dass Darmbakterien bei oraler Einnahme dessen Abbau fördern können – ein weiteres Argument für die s.c.-Applikation. Hydroxychloroquin (HCQ) ist zwar ein sicheres Medikament, bei Patienten mit anamnestischer Herzinsuffizienz-Hospitalisierung war es aber versus MTX mit einem erhöhten kardiovaskulären (CV) Risiko verbunden. GK sollten möglichst nicht mit PPI kombiniert werden – dies treibt das Risiko osteoporotischer Frakturen noch mehr in die Höhe. In einer Studie war nach Versagen eines Nicht-TNFi-bDMARD der Wechsel auf einen TNFi effektiver als der Switch auf ein zweites Nicht-TNFi-bDMARD. Bei Patienten mit RA und gleichzeitiger DIP-Arthrose sollte aufgrund eines erhöhten Risikos der radiologischen Progression der Arthrose eine Kombination mit csDMARD einer bDMARD-Monotherapie vorgezogen werden. In stabiler Remission kann nach den Ergebnissen der RETRO-Studie ein DMARD-Tapering ins Auge gefasst werden, Risiken für ein Rezidiv sind ACPA-Positivität, weibliches Geschlecht, bDMARD-Gebrauch, längere RA-Dauer und höherer DAS28 zu Baseline.
Zu guter Letzt noch zu den JAKi und den Folgerungen aus der ORAL Surveillance-Studie zu Tofacitinib. (5) Hier sind weiter viele Fragen offen, so ob es sich um einen substanz- oder klassenspezifischen Effekt handelt (eine entsprechende Sicherheitsstudie zu Baricitinib bei RA-Patienten ≥50 Jahre mit CV-Risikofaktoren läuft derzeit) und inwiefern die Ergebnisse von der RA auf andere Indikationen übertragbar sind. Generell bleibt unklar, ob das Risiko (MACE, venöse Thromboembolien, Malignitäten) unter Tofacitinib erhöht oder unter TNFi niedriger war. Bisherige Baricitinib-Langzeitdaten über 9 Jahre lassen auf ein leicht erhöhtes Risiko für schwere CV-Ereignisse (MACE) in einem ORAL Surveillance ähnlichen Kollektiv schließen, im Falle von Upadacitinib fehlt es noch an ausreichend langen Beobachtungszeiten. Ob es einer Neupositionierung der JAKi in der neuen EULAR-Leitlinie bedarf, ist noch offen.
Infektionen: COVID-19 und mehr
Die erneut undankbarste Aufgabe hatte Prof. Dr. Christian Kneitz, Rostock, der Infektionen und die damit weiter einhergehende Informationsflut zu COVID-19 in Angriff nehmen musste. Jenseits von COVID-19 herausgegriffen sei die Hepatitis B. Zu deren Prophylaxe, Diagnostik und Therapie legte die DGVS eine S3-Leitlinie vor (6), deren Lektüre lohnenswert ist. Alle Patienten unter immunsuppressiver Therapie sollten auf Anti-HBc und HBs-Ag (sowie möglichst Anti-HBs) getestet werden. Die Erfordernis einer (nur) engmaschigen Kontrolle oder antiviralen Therapie bei HBs-Ag-positiven Patienten hängt vom Reaktivierungsrisiko ab (hoch: >10 %, mittel: 1-10 %, niedrig <1 %). Ein hohes Risiko besteht unter Rituximab, GK >10 mg/Tag über 4 Wochen und Cyclophosphamid (CYC), ein moderates unter GK <10 mg/Tag über 4 Wochen, TNFi und anderen Zytokin-Inhibitoren sowie JAKi, ein niedriges unter GK <4 Wochen, i.a. GK, MTX und Azathioprin. Eine aktuelle Studie kommt jedoch zu dem Schluss, dass auch Abatacept ein hohes Reaktivierungsrisiko birgt.
Zu COVID-19: Für die meisten Patienten ist das Erkrankungsrisiko und für einen schlechten Verlauf leicht erhöht. Eine Basistherapie sollte aufgrund des Schubrisikos nicht abgesetzt werden, jedoch GK möglichst reduziert oder gemieden und Rituximab nur nach strenger Indikationsstellung verordnet werden. Außer einer laufenden Low-dose-GK-Therapie sollten bei einer COVID-19-Infektion Immunsuppressiva möglichst pausiert werden. Risikofaktoren für einen ungünstigen Verlauf sind hohe Krankheitsaktivität, schwere Verläufe mit hohem GK-Bedarf, eine Therapie mit Rituximab und JAKi, Kollagenosen und Komorbiditäten. Die Impfungen sind meistens gut wirksam, das Sicherheitsprofil überwiegend gut und auch Krankheitsschübe sind selten. Patienten mit den genannten Risikofaktoren (und Hypogammaglobulinämie) sollten früh geimpft bzw. geboostert werden. Die Impfung sollte 4 Wochen vor Rituximab, der Booster nach B-Zell-Repopulation erfolgen. Wenn möglich sollten MTX (für 10-14 Tage gerade bei Älteren), Abatacept, JAKi und Mycophenolat Mofetil (MMF) vor bzw. nach der Impfung pausiert werden. Unter einer intensiven Immunsuppression kann eine Bestimmung der Antikörper sinnvoll sein.
Arthrose, Schmerz und Fibromyalgie
Die Themen Arthrose, Schmerz und Fibromyalgie behandelte Prof. Dr. Christoph Bärwald, Leipzig. Als neuer Biomarker für die Entwicklung und Progression einer Arthrose könnte sich CRTAC1 erwiesen – noch fehlt es aber an Evidenz. Als Nebenergebnis der CANTOS-Studie zu Canakinumab zeigte sich, dass IL-1 in die Pathogenese involviert ist – therapeutische Implikationen hat dies aber nicht. So geben die ACR-Leitlinien eine Empfehlung für NSAR und i.a.-Steroidinjektionen (neuere Studien stellen dies allerdings in Frage), aber gegen cs/bDMARDs (HCQ, MTX, TNFi, IL-1Ri), Glucosamin, Bisphosphonate, Plättchen-reiches Plasma, Stammzellinjektionen und TENS. (7) Eine neue Therapieoption könnte der duale Kinase-Inhibitor (CLK2, DYRK1A) Lorecivivint, ein Modulator des Wnt-Signalwegs, sein, der in Phase-IIb eine signifikante Reduktion von Schmerzen und Verbesserung des WOMAC-Scores bot.
In Bezug auf Schmerzen stehen am Ionenkanal TRPV1 ansetzende Therapien im Fokus – mit Resiniferatoxin wird ein potenter TRPV1-Agonist bei Gonarthrose in Phase-III geprüft. Auch IL-1b scheint bei entzündungsbedingtem Schmerz eine Rolle zu spielen. Beim Fibromyalgie-Syndrom(FMS), mit dessen Diagnose als Folge von COVID-19 künftig noch häufiger zu rechnen ist, könnte niedrigdosiertes Naltrexon eine Option sein (Ansprechen bei 50 bzw. 95 % der Patienten mit Dosierungen von 3,88 bzw. 5,4 mg), ferner mit teilweise sehr guten Effekten auch
eine serielle Ganzkörperkältetherapie oder Grünlichttherapie.
Pädiatrische Rheumatologie
Aktuelle Aspekte aus der pädiatrischen Rheumatologie besprach Prof. Dr. Gerd Horneff, Sankt Augustin. Bei juveniler idiopathischer Arthritis(JIA) erreichen neuen Daten zufolge nach 18 Jahren etwa ein Drittel der Patienten eine medikamentenfreie Remission, recht gut ist die Prognose bei oligoartikulärer und systemischer JIA (sJIA), schlechter bei Enthesitis-assoziierter Arthritis (ERA-JIA; Spondyloarthritis) und polyartikulärer JIA (pJIA), wo häufig eine Weiterversorgung in der Erwachsenenrheumatologie erforderlich ist. Zu denken ist auch an die größere Prävalenz begleitender Autoimmunerkrankungen (z. B. Uveitis), auch bei JIA-Patienten in klinischer Remission ist das Risiko eines Kiefergelenkbefalls zu beachten. Ein Juveitis-Screening sollte sofort bei V. a. JIA erfolgen und über bis zu 8 Jahre fortgesetzt werden. Gut geeignet zum Monitoring einer JIA-Uveitis ist die optische Kohärenztomografie (OCT). Eine frühzeitige Kombination von MTX mit einem bDMARD bot kurz- aber nicht langfristig bessere Ergebnisse als ein Step-up-Protokoll. Auch in der STOP-JIA-Studie erreichten kurzfristig unter einer frühzeitigen csDMARD/bDMARD-Kombination mehr JIA-Patienten eine JADAS-Remission. Insbesondere die sJIA ist mit einem Makrophagenaktivierungssyndrom (MAS) assoziiert. In solchen Fällen scheint neben Steroiden eine Therapie mit Anakinra oder JAKi (z. B. Ruxolitinib) effektiv zu sein.
Nicht näher eingegangen sei an dieser Stelle auf die autoinflammatorischen Erkrankungen, wertvolle Hinweise zur Gendiagnostik sind einer aktuellen Übersichtsarbeit zu entnehmen. (8) Stattdessen noch einige Worte zum COVID-19-getriggerten Pediatric Inflammatory Multisystem Syndrome (PIMS bzw. MISC), das starke Ähnlichkeiten zum Kawasaki-Syndrom aufweist und auch identisch behandelt wird (intravenöse Immunglobuline je nach Schwere kombiniert mit GK), Details werden in einer kürzlich veröffentlichten ACR-Leitlinie erörtert. (9)
Axiale Spondyloarthritis
In Bezug auf die axiale Spondyloarthritis (axSpA) könnten laut PD Dr. Uta Kiltz, Herne, künftig polygene Risikoscores, die eine höhere Trennschärfe als HLA-B27-Positivität, MRT und CRP aufweisen, die Frühdiagnose erleichtern. Die Unterdrückung der Krankheitsaktivität bliebt das wichtigste Ziel, um eine radiologische Progression zu verhindern – bei deren Voranschreiten (Nicht-, Spät-, Früh, Schnell-Progressoren) zeigt sich jedoch eine erhebliche Variabilität. Risikofaktoren sind Strukturschäden im MRT, männliches Geschlecht, längere Krankheitsdauer, erhöhtes CRP und Rauchen. In puncto Fibromyalgie ist zu beachten, dass eine solche sich zwar bei vielen Patienten im Verlauf entwickelt, noch häufiger verschwindet diese aber unter Therapie. Noch mehr geachtet werden muss auf Depressionen und Ängste, die das Therapieansprechen und die Adhärenz verschlechtern und sich auch in PROs wie dem BASDAI- oder ASDAS-Score niederschlagen. Zur Optimierung der rheumatologischen Versorgung von axSpA-Patienten wurden seitens der DGRh Qualitätsstandards formuliert, die Mitte letzten Jahres publiziert wurden und unbedingt beachtet werden sollten. (10)
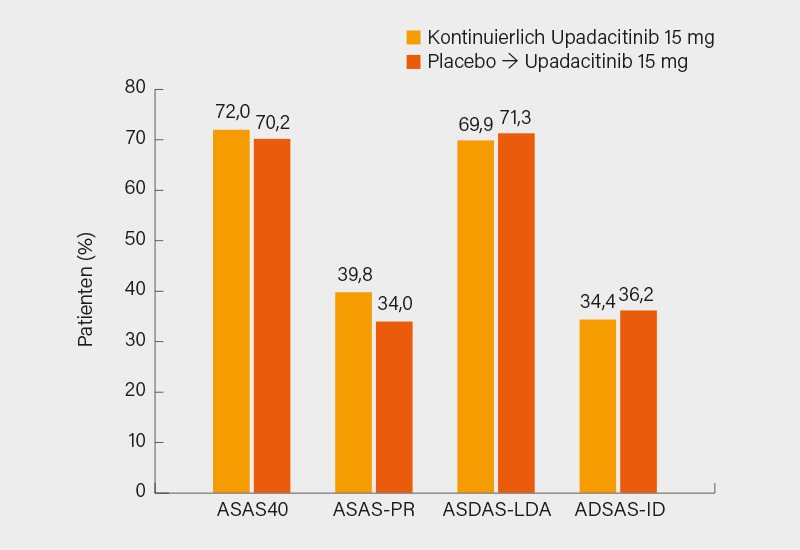
Bei der axSpA hat mit den JAKi Tofacitinib und Upadacitinib ein drittes Wirkprinzip Einzug in die medikamentöse Therapie gehalten. Nach 64 Wochen erreichten unter Upadacitinib ca. 70 % der r-axSpA-Patienten ein ASAS40-Ansprechen und ca. 35 % eine ASDAS inaktive Erkrankung (Abb. 2). Nach den Daten zur Therapiereduktion unter Certolizumab wurde nun auch für Ixekizumab in COAST-Y eine Absetzstrategie geprüft. Nach 40 Wochen blieben nach IL-17i-Entzug 55 % der r/nr-axSpA-Patienten schubfrei, nach der Wiederaufnahme von Ixekizumab nach einem Schub erreichten 93 % wieder eine geringe Krankheitsaktivität oder Remission – die geeignete Patientenselektion ist noch unklar. Die Cluster-randomisierte TICOSPA-Studie zeigte keinen eindeutigen Vorteil einer Treat-to-target-Strategie bei axSpA, was jedoch auch am Studiendesign und dem gewählten Endpunkt gelegen hat – ein gewisser Nutzen mit mehr bDMARD-Therapien war durchaus gegeben. Schon überleitend zur Psoriasis-Arthritis (PsA) wurde in der mit dem IL-17i Secukinumab durchgeführten MAXIMISE-Studie ein gutes Ansprechen auch der Achsenskelettmanifestationen bei PsA gezeigt – zur axialen PsA inklusive deren Definition bleiben aber noch viele Fragen offen.
Psoriasis-Arthritis
Über die die Neuigkeiten zur PsA referierte im Anschluss PD Dr. Axel Hueber, Nürnberg. Die erfreuliche Nachricht zu Beginn: Eine große griechische Analyse ergab für PsA-Patienten eine gegenüber der Allgemeinbevölkerung nicht (mehr) erhöhte Gesamtmortalität. Auch wenn es sich bislang nur um retrospektive Beobachtungsstudien handelt, so mehren sich die Hinweise, dass eine konsequente Therapie der Psoriasis mit bDMARDs den Übergang zur PsA verzögern oder verhindern könnte. Bei früher PsA wurde die Daktylitis als Indikator für einen schweren Verlauf identifiziert. Dass das Mikrobiom in der Pathogenese der PsA eine wichtige Rolle spielt, ist zwar evident, der erste Versuch in einer kontrollierten Studie PsA-Patienten mittels Stuhltransplantation zu behandeln scheiterte jedoch. Ein neuer Anlauf mit wöchentlichen Kapseln (oral einzunehmen) ist geplant, die Akzeptanz bleibt abzuwarten.
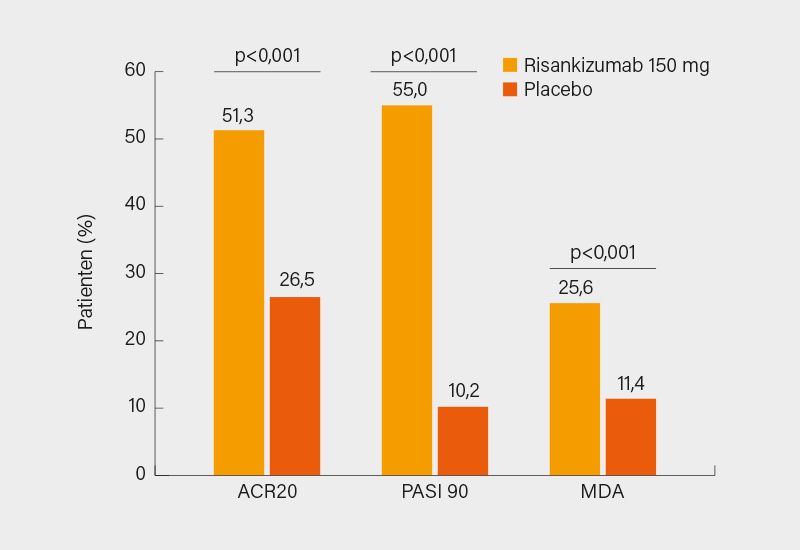
Zur medikamentösen PsA-Therapie: Nachdem die SEAM-PsA-Studie gezeigt hatte, dass eine Etanercept-Monotherapie der Kombination aus Etanercept und MTX gleichwertig war, bestätigte sich dies auch in einer Post-hoc-Analyse zu den SPIRIT-P1/P2-Studien, in denen MTX das Ansprechen auf Ixekizumab nicht verbesserte (minimale Krankheitsaktivität, MDA, in Woche 52: Kombi 35 % vs. Mono 39 %). Nicht anders war das Ergebnis in der MUST-Studie zu Ustekinumab mit/ohne MTX, sodass viel für eine bDMARD-Monotherapie spricht. In der prospektiven Beobachtungsstudie zeigte sich unter Ustekinumab (obwohl häufiger Mono und in Drittlinie gegeben) und TNFi ein ähnlich gutes Ansprechen. Nach Guselkumab steht nunmehr mit Risankizumab ein zweiter IL-23i zur Verfügung. Das Ansprechen in den beiden Phase-III-Studien KEEPSAKE-1 und- 2 war gut (Abb. 3), einen MDA in Woche 24 erreichten jeweils ca. 25 % der Patienten (ohne Effekt eine bDMARD-Vortherapie), was im Bereich anderer bDMARDs liegt. Ein großer Pluspunkt der IL-23i sind die bislang exzellenten Sicherheitsdaten. Im Falle von Guselkumab war ein Ansprechen der Enthesitis nach 52 Wochen mit einer besseren Krankheitskontrolle assoziiert (MDA 42 % vs. Nicht-Ansprechen 17 %). Mit Tildrakizumab scheint nach positiven Phase-II-Daten (MDA in Woche 24 33 %) ein weiterer IL-23i auf einem guten Weg zur Zulassung zu sein. Noch schwierig erscheint ein Absetzen von bDMARDs bei anhaltender klinischer Remission: In SPIRIT-P3 führte das Absetzen von Ixekizumab nach 52 Wochen in ca. 80 % der Fälle zu einer erneuten Krankheitsaktivität, immerhin wurde zu 96 % nach ca. 4 Wochen mit dem IL-17i wieder eine MDA erreicht. Ein letzter Punkt zu den IL-17i: In einer großen französischen Analyse war das Risiko für eine CED zwar gegenüber Apremilast klar erhöht, aber auf einem mit Etanercept vergleichbarem Niveau (auch wenn ein Vergleich mit anderen TNFi aussagekräftiger wäre).
Groß- und Kleingefäßvaskulitiden
Nichts relevant Neues gab es zur Polymyalgia rheumatica (PMR), so Prof. Dr. Bernhard Hellmich, Kirchheim/Teck, viel hingen zur Riesenzellarteriitis (RZA). Diagnostisch war die Farbduplexsonografie bereits die Methode der Wahl, eine neue Studie belegt nun auch deren Nutzen in der Verlaufsbeobachtung unter GK. Die Aktivität geht langesamer zurück als in der Klinik und an der A. temporalis wiederum schneller als an der A. axillaris. Für die niedergelassene Praxis weniger relevant ist die PET-CT, die jedoch zum Follow-up unter GK, MTX und Tocilizumab gut geeignet ist. In erster Linie wäre diese eine Option bei nicht konklusivem Ultraschall. Interessant sind einige Abweichungen der neuen ACR-Leitlinie zur RZA und Takayasu-Arteriitis (11) im Vergleich zu den DGRh- und EULAR-Empfehlungen, die primär unterschiedlichen Gesundheitssystemen und Gewichtungen geschuldet sind. (12) Zu Tocilizumab wurden Langzeit-Follow-up-Daten der GiACTA-Studie vorgestellt, die nach Therapieende eine Rezidivrate >50 % belegen, andererseits anhaltende GK-sparendende Effekte. Letztlich bedarf es einer individuellen Entscheidung zur Therapiefortführung unter Berücksichtigung der Vor- und Nachteile, oft dürfte eine Intervallverlängerung sinnvoll sein. Der Versuch, die GK-Therapie zu früh zugunsten von Tocilizumab zu beenden, erwies sich in der GUSTO-Studie als zu riskant (1x irreversibler Visusverlust), letzteres benötigt 12-16 Wochen bis zur vollen Wirkung, weshalb GK nicht vorschnell abgesetzt werden sollten.
Für die ANCA-assoziierten Vaskulitiden (AAV) wurden gleich drei neue Leitlinien (ACR/VF, KDIGO, CanVasc) vorgestellt. (13-15) Bei kleineren Unterschieden werden Rituximab oder Cyclophosphamid (CYC) zur Remissionsinduktion empfohlen, eine raschere GK-Reduktion (≤10 mg nach 3 Monaten), eine Plasmapherese nur noch in Ausnahmefällen (als Konsequenz aus der PEXIVAS-Studie), Rituximab als neuer Standard in der Remissionserhaltung, die für 24-48 Monate oder länger fortgeführt werden sollte. Eine japanische Studie lieferte Anhaltspunkte dafür, dass eine GK-Startdosis von 30 mg gleich wirksam (aber weniger toxisch) wie 60 mg ist, zumindest für de-novo MPA-Patienten ohne schwere Organbeteiligung wäre dies eine Option. Neu zugelassen bei AAV ist auf Basis der Phase-III-Studie ADVOCATE-Studie der Komplement 5a (C5a)-Ri Avacopan. In der Remissionsinduktion war es der GK-Standardtherapie ebenbürtig, bei Nierenbeteiligung war eine bessere Erholung der Nierenfunktion ersichtlich. Die GK-Toxizität war unter Avacopan geringer, nicht aber generell Infektionen und unerwünschte Ereignisse. In der Remissionserhaltung kam es zu weniger Rezidiven, manche Fragen sind aber noch offen, so fehlt es an Daten zur Kombination mit Rituximab als Erhaltungstherapie. In die neuen EULAR-Empfehlungen zu AAV, die im Juni beim EULAR vorgestellt werden, und das Update der DGRh, mit dem in 2023 zu rechnen ist, wird auch der neu bei EGPA zugelassene IL-5i Mepolizumab eingehen, der erfolgreich in der Phase-III-Studie MIRRA geprüft wurde. Bereits jetzt wird er in der aktuellen ACR-Leitlinie bei EGPA ohne schwere Organbeteiligung empfohlen, bei schwerer Organmanifestation werden CYC oder Rituximab präferiert. Die nachträgliche Evidenz für dieses Statement lieferte die REOVAS-Studie, in der sich CYC und Rituximab in der EGPA-Induktionstherapie als gleichwertig erwiesen (Abb. 4).
Systemischer Lupus erythematodes
Das Update zum SLE und Antiphospholipidsyndrom (APS), zu dem es keine wesentlichen Neuigkeiten gab, übernahm Prof. Dr. Christof Specker, Essen. Im Kontext der EULAR/ACR-Klassifikationskriterien mit sehr niedrigem ANA-Grenztiter wurde erneut auf die in den letzten 20-30 Jahren verdoppelte Prävalenz von ANA in der Allgemeinbevölkerung hingewiesen. Für die Lupusnephritis (LN) werden zwei diagnostische Urin-Biomarker diskutiert, neben IL-16 scheint vor allem CD163 sehr vielversprechend zu sein. Zum verantwortungsvollen Einsatz von GK bei (nicht nur) SLE erschien eine empfehlenswerte Übersichtsarbeit (16), im Hinblick auf HCQ zeigt eine neue Metaanalyse die bei korrekter Anwendung gute kardiovaskuläre und ophthalmologische Sicherheit dieser essenziellen Basistherapie.
Gleich drei neue Medikamente gibt es bzw. wird es beim SLE und der LN geben: Trotz der diskrepanten Ergebnisse aus den Phase-III-Studien TULIP-1 und -2 wurde kürzlich der Typ-1 Interferon (IFN)-Ri Anifrolumab zugelassen. Insgesamt wurde eine relevante Verbesserung der Krankheitsaktivität mit potenzieller Reduktion des Steroidbedarfs und weniger Schüben nachgewiesen, wobei vor allem positive Effekte auf die Haut gesehen wurden. Der genaue Stellenwert der Substanz muss erst noch in der praktischen Anwendung definiert werden. Dies gilt bei aktiver LN auch für den Einsatz von Belimumab, das nach den positiven Ergebnissen der Phase-III-Studie BLISS-LN die entsprechende Indikationserweiterung erhielt. Eine neue, effektive Therapie bei aktiver LN bietet gemäß den Daten der Phase-III-Studie AURORA der kurz vor Zulassung stehende Calcineurin-Inhibitor Voclosporin. Das renale Ansprechen blieb auch über 2 Jahre hinweg stabil, die bisherigen Sicherheitsdaten sind ebenfalls vorteilhaft.
Bei LN ist – nach vielversprechenden langfristigen Phase-II-Daten – für den Anti-CD20-Antikörper Obinutuzumab, quasi ein Rituximab 2.0, die Phase-III-Studie REGENCY angelaufen, ein positiver Ausgang gilt als wahrscheinlich. Auch in Phase-III geprüft werden soll als Anti-APRIL-Therapie das IgG1-Fusionsprotein Atacicept bei aktiver LN (nachdem es beim SLE trotz guter Wirksamkeit, aber problematischem Sicherheitsprofil bereits aus dem Rennen zu sein schien). Beim SLE vielversprechend und seit Kurzem ebenfalls in Phase-III geprüft wird nach positiven Phase-II-Ergebnissen der CD40-Antikörper Dapirolizumab. Bei schwerem therapierefraktärem SLE liegen zudem erste positive Erfahrungen zu dem CD38-Antikörper Daratumumab vor, in ansonsten „ausweglosen“ Fällen bleibt die teure CAR-T-Zelltherapie als letzte Option – die Ergebnisse bei den ersten 5 Erlanger Patienten sind (zumindest kurzfristig) spektakulär.
Sjögren-Syndrom, Myositiden und systemische Sklerose
Den Schlusspunkt zu den anderen Kollagenosen setzte Prof. Dr. Gabriela Riemekasten, Lübeck. Beim primären Sjögren-Syndrom (pSS) liefert die aktuelle EULAR-Leitlinie gute Anhaltspunkte für jede Krankheitsmanifestation. Die Mundtrockenheit kann mit Schirmer-Teststreifen (lacrimal, oral, parotal) noch besser erfasst werden. Als Therapieoption sollte auch eine Spülung mittels Speicheldrüsenendoskopie (durch den HNO-Arzt) erwogen werden, eine Kochsalzlösung mit/ohne Triamcinolon verbesserte nicht nur den Speichelfluss, sondern auch PROs wie den ESSPRI. Bei schwerer PSS-assoziierter Fatigue wurde mit gewissem Erfolg die transkranielle Hirnstimulation erprobt. Das Highlight des letzen Jahres war aber eine erfolgreiche Phase-II-Studie zu dem BAFF-Ri Ianalumab. Empfehlenswert ist überdies die Lektüre einer Leitlinie zum PSS-Management bei pulmonaler Beteiligung. (17)
Für die Diagnose einer Myositis gibt es keine verlässlichen klinischen Zeichen (abgesehen womöglich von Autoantikörpern). Während das MRT nicht immer konklusiv ist, scheint die PET-CT prognostisch bedeutsam zu sein. Bei MDA5-positiver Myositis mit ILD sollte bei sauerstoffpflichtigen bzw. progredienten Patienten eine Plasmapherese erwogen werden, die sich in einer kleinen Studie als gut wirksam herausstellte. Zur Behandlung der Dermato- bzw. Polymyositis könnte, trotz aufgrund zu geringer Teilnehmerzahl fehlender statistischer Signifikanz in einer kontrollierten Studie, Belimumab künftig eine Option sein (deutliche Verbesserung bei 62 vs. 35 % der Patienten unter Standardtherapie). Auch die bekannten Calcineurin-Inhibitoren erscheinen vielversprechend mit womöglich leichten Vorteilen von Tacrolimus gegenüber Ciclosporin.
Bei diffus-kutaner systemischer Sklerose (dcSSc) ist die normale Lungenfunktionstestung zu unzuverlässig, es muss eine HRCT durchgeführt werden. Die positiven Effekte von Tocilizumab auf den Progress der ILD in der HRCT sind umso stärker, desto ausgeprägter die Aktivität ist. Retrospektive Daten zeigen, dass eine frühe Therapie (CYC, MMF oder Tocilizumab) die Prognose verbessert und das ILD-Risiko verringert. Eine gute Wirkung auf den Haustscore (mRSS) und die Lunge (FVC%) wurde erstmals in einer kontrollierten Studie für Rituximab nachgewiesen. Bei schweren Verläufen scheint die Stammzelltransplantation nach bisherigen Daten der ASTIS-Studie der konventionellen Therapie nicht überlegen zu sein. Erst kürzlich zeigte eine Studie bei SSc-Patienten mit multipler Organbeteiligung eine gute, stabilisierende Wirkung der Kombination aus Rituximab und CYC. Eine neue Analyse zu Nintedanib lässt auf eine für den individuellen Patienten gute Wirksamkeit schließen (44 % mit Verbesserung der ILD, 41 % stabil, nur 15 % schlechter). Potenzielle neue Therapieoptionen sind Tofacitinib (Verbesserung von Hautfibrose und Gelenken, weniger digitale Ulzerationen) und Eculizumab bei mit SSc- oder Myositis-assoziierter thrombotischer Mikroangiopathie. Bei fäkaler Inkontinenz scheint eine sakrale Nervenstimulation (88 % mit Ansprechen) effektiv und einem Training der Beckenmuskulatur überlegen zu sein.
Quelle: 17. Rheumatologie-Update-Seminar, Mainz/Livestream, 25./26. März 2022
Ausgewählte Literatur: 1 Buschulte K et al., Z Rheumatol 2021; 80(8): 743-753 | 2 Nagy G et al., Ann Rheum Dis 2022; 81(1): 20-33 | 3 Leipe J et al., Z Rheumatol 2021; 80(Suppl 2): 49-63 | 4 Fraenkel L et al., Arthritis Rheumatol 2021; 73(7): 1108-1123 | 5 Ytterberg SR et al., N Engl J Med 2022; 386(4): 316-326 | 6 Cornberg M et al., Z Gastroenterol 2021; 59(7): 691-776 | 7 Kolasinski SL et al., Arthritis Rheumatol 2020; 72(2): 220-233 | 8 Schnappauf O. Z Rheumatol 2020; 79(7): 611-623 | 9 Henderson LA et al., Arthritis Rheumatolo 2021; 73(4): e13-e29 | 10 Kiltz U et al., Z Rheumatol 2021; doi: 10.1007/s00393-021-01019 | 11 Maz M et al., Arthritis Rheumatol. 2021; 73(8): 1349-1365 | 12 Hellmich B, Buttgereit F. Nat Rev Rheumatol 2021;17(11): 649-650 | 13 Chung A et al., Arthritis Rheumatol 2021; 73(8): 1366-1383 | 14 Rovin BH et al., Kidney Int 2021; 100(4S): S1-S276 | 15 Mendel A et al., J Rheumatol 2021; 48(4): 555-566 | 16 Fischer-Betz R, Schneider M. Z Rheumatol 2021; 80(4): 332-338 | 17 Lee AS et al., Chest 2021; 159(2): 683-698
Hot topic: Rheuma und Niere
Nur kurz eingegangen sei auf den exzellenten Hot topic-Vortrag von Prof. Dr. Stefan Weiner, Trier, in dem Neuerungen in der Diagnostik (neue CKD-Epi-Formel zur eGFR-Berechnung), im Monitoring (Dickkopf-3 im Urin als Marker für Niereninsuffizienz) und Management der renalen Beteiligung bei Autoimmunerkrankungen dargelegt wurden. Von direktem praktischem Interesse ist der Befund, dass Allopurinol und Febuxostat nur im Stadium 2-3a und fehlender Proteinurie einen positiven Einfluss auf die eGFR ausüben, nicht aber im Stadium 3-4 und mit großer Proteinurie. Künftig sehr spannend wird der Einsatz von SGLT-2-Inhibitoren, für die eine renale Protektion jenseits des Typ-2-Diabetes evident ist. Kontrollierte Studien zu dieser Substanzklasse in rheumatologischen Indikationen wären absolut wünschenswert.
Update zur Gichtarthritis
Über Neuigkeiten zur Gicht berichtete Prof. Dr. Bernhard Manger, Erlangen. Die US-amerikanische CARES-Studie hatte gezeigt, dass Febuxostat im Hinblick auf das Auftreten von CV-Ereignissen Allopurinol nicht unterlegen, aber mit einer erhöhten CV- und Gesamtsterblichkeit assoziiert war. In der europäischen FAST-Studie waren hingegen keine relevanten Unterschiede bei CV-Ereignissen und -Mortalität erkennbar, im Hinblick auf die Gesamtmortalität schnitt Feboxostat im Trend sogar besser ab. Als Fazit auch auf Basis einer Metaanalyse und großen Kohortenstudie bleibt, dass Febuxostat versus Allopurinol in Bezug auf die CV-Sicherheit bei Gichtpatienten mit erhöhtem CV-Risiko nicht unterlegen ist, sodass der Rote Hand-Brief zu Febuxostat eigentlich zurückgenommen werden müsste.