Die Frage, ob und bei welchen Patienten mit „präklinischer RA“ eine frühe medikamentöse Intervention gerechtfertigt wäre, bleibt weiter offen. So konnte diesbezüglich die TREAT-EARLIER-Studie mit Methotrexat (MTX) nur bedingt überzeugen, ähnliches gilt trotz durchaus positiver Ergebnisse für die ARIAA-Studie mit Abatacept, die bei ACPA-positiven „at-risk“-Personen zumindest auf eine gewisse Verzögerung der Progression zur RA hinwies. In diese Richtung weist nun auch die von Andrew Cope, London (Großbritannien), und Kollegen vorgestellte randomisierte, doppelblinde, placebokontrollierte Phase-IIb-Studie APIPPRA. In der Studie wurden 213 ACPA+/RF+- oder ACPAhi (≥3 x ULN)/RF-Individuen mit Arthralgie (keine frühere klinische Synovitis, keine vorherigen Steroide oder DMARDs) eingeschlossen und stratifiziert nach Geschlecht, Raucherstatus und Land (UK oder Niederlande) für 52 Wochen auf 1x/Woche s.c. Abatacept 125 mg (n=110) oder Placebo (n=103) randomisiert (im Mittel 49 Jahre, 77 % Frauen, 93 % ACPAhi, max. moderate subklinische Synovitis, 73 % mit Power-Doppler-Score =0). Nach Beendigung der Therapie schloss sich ein Follow-up über weitere 52 Wochen an. Primärer Endpunkt war die Entwicklung einer klinischen Synovitis in ≥3 Gelenken oder einer RA (ACR/EULAR-Kriterien 2010).
APIPPRA: Teilerfolg für Frühintervention mit Abatacept
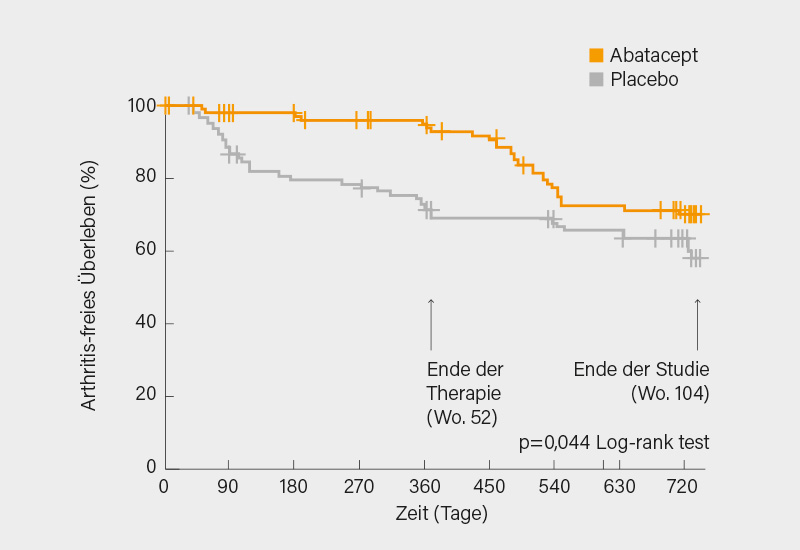
Insgesamt kam es zu 65 primären Endpunkt-Ereignissen, in Woche 52 waren es 30 (29 %) unter Placebo und 7 (6 %) unter Placebo, nach 104 Wochen 38 (37 %) im Vergleich zu 27 (25 %), woraus sich ein mittleres Arthritis-freies Überleben zwischen den Therapiearmen von 99,2 Tagen (95% KI 37,5-160,9; p=0,002) zugunsten von Abatacept ergibt. Der Effekt war im ersten Jahr (mit Therapie) deutlich größer (Hazard Ratio, HR 0,20; p=0,002) als im zweiten Jahr, wobei der signifkante Vorteil von Abatacept erhalten blieb (HR 0,61; p=0,003) (Abb. 1). Eine Post-hoc-Analyse ergab, dass Individuen mit besonders hohem Risiko (n=49), d. h. mit hohem IgG ACPA-Antikörperspiegel plus Positivität für andere Biomarker (RF, IgA ACPA, Anti-CarP, AAPA) mit größerer Wahrscheinlichkeit unter Abatacept Arthritis-frei blieben: Nur 10 % entwickelten nach zwei Jahren eine klinische Arthritis im Vergleich zu 50 % unter Placebo. Bei insgesamt guter Verträglichkeit von Abatcept profitierten die Teilnehmer während der Therapie von weniger druckschmerzhaften Gelenken und niedrigeren Schmerz-Scores. (1) Eine längere präventive Abatacept-Therapie wäre wohl vertretbar und hätte noch bessere Effekte erzielt, dennoch dürfte diese Strategie noch nicht reif für die Praxis sein.
Künstliche Intelligenz auf dem Vormarsch
Bei früher Arthritis und klinisch suspekter Arthralgie (CSA) können KI/Machine Learning (ML) auf Basis von MRT-Scans der Hände bei der Prädiktion einer RA helfen. Wie Yanli Li, Leiden (Niederlande), und Kollegen darlegten, wurden MRT-Scans des Handgelenks inkl. MCP- und ggf. MTP-Gelenken bei gesunden Kontrollen (n=177), Individuen mit CSA (n=692; davon entwickelten 113 nach 2 Jahren eine RA) und Patienten mit Früharthritis (EA; n=969; davon 447 mit RA, 358 mit undifferenzierter Arthritis und 164 mit Nicht-RA) verglichen. Die Unterscheidung zwischen den Gruppen mit MRT-Scans gelang gut (EA vs. Kontrollen: AUROC 0,84; CSA vs. Kontrollen: AUROC 0,83; RA vs. Nicht-RA bei EA: AUROC 0,71). Auch die Prädiktion einer RA bei CSA war mit einer AUROC von 0,73 passabel. Damit erreicht die KI ungefähr Expertenlevel, weitere Fortschritte sind rasch zu erwarten. KI-generierte Heatmaps könnten überdies künftig als neue Imaging-Biomarker dienen. (2)
JAK-Inhibitoren: Sicherheitsaspekte aus allen Blickwinkeln
Obwohl die Arbeit nicht die JAK-Inhibitoren berührt, sei zunächst ein Abstract einer Gruppe um Bénédicte Delcoigne, Stockholm (Schweden), erwähnt, das die überragende Bedeutung des Erreichens einer Remission für die Verhinderung akuter Koronarsyndrome (ACS) bei RA verdeutlicht: Eine Analyse schwedischer und norwegischer Register (14.488 Therapiezyklen mit MTX, 13.056 mit TNFα-Inhibitoren, TNFi) ergab nach einem Follow-up von 12 Monaten, dass Patienten, die unter TNFi oder MTX eine Remission erreichen, ein ähnlich geringes ACS-Risiko aufweisen (HR 1,19), das nach Adjustierung auf Alter und Geschlecht wiederum vergleichbar mit jenem der Allgemeinbevölkerung war. (3) Nun zur von Roman Aymon, Genf (Schweiz), und Kollegen vorgestellten JAK pot-Studie, in die 14 internationale Real-World-Register eingehen und in der RA-Patienten mit Einstellung auf JAK-Inhibitoren (JAKi), TNFi oder anderen bDMARDs (OMA) auf das Risiko für schwere kardiovaskuläre Ereignisse (MACE) untersucht wurden (50.325 Therapiezyklen, 182 MACE). Sowohl in der Gesamtkohorte als auch in einer Subanalyse, die nur die Einschlusskriterien der ORAL Surveillance-Studie erfüllende Patienten (38,4 %) berücksichtigte, fand sich kein höheres MACE-Risiko unter JAKi vs. TNFi, dies galt nach Adjustierung auch für OMA vs. TNFi. (4) Eine südkoreanische Gruppe um Sung Soo Ahn, Yongin, belegte auf der Basis von nationalen Gesundheitsdatenbanken, dass bei Patienten mit seropositiver RA (>100.000) das Risiko für kardiovaskuläre Erkrankungen und Malignitäten unter JAKi/bDMARDs nicht gegenüber csDMARDs erhöht war (Incidence Rate Ratio, IRR 0,88 bzw. 0,91) und auch nicht für JAKi vs. bDMARDs oder csDMARDs. (5)
Das unter JAKi erhöhte Zoster-Risiko ist gut belegt, anderseits gab es bislang kaum Daten zum Shingrix-Impfstoff bei Rheuma- bzw. RA-Patienten, geschweige denn solchen auf JAKi. Dies ändert nun eine von Kevin Winthrop, Portland (USA), und internationalen Kollegen vorgelegte Substudie während der Open-label-Extension der Phase-III-Studie SELECT-COMPARE, in der 90 Patienten bereits auf einer stabilen Therapie mit Upadacitinib (15 mg) und MTX waren. Die zwei Shingrix-Dosen wurden in 3-monatigem Abstand geimpft, das Ansprechen darauf jeweils 4 Wochen später erfasst. Auch wenn die Ergebnisse nicht so gut wie bei immunkompetenten Menschen ausfielen, sind sie doch eine gute Rückversicherung. Vier Wochen nach der zweiten Dosis zeigten 88 % der Patienten ein humorales Ansprechen, mit ähnlichen Raten bei älteren oder mit Steroidtherapie. Ein zelluläres Ansprechen fand sich bei 66 % der Teilnehmer, nur in 2 Fällen kam es zu einem temporären Schub der RA. (6)
Gute Phase-II-Daten zu neuem JAK-1/TYK-2-Inhibitor
Zu guter Letzt nun zu den von Chris Liang, Peking (China), und Kollegen vorgestellten Interimsergebnissen einer randomisierten, doppelblinden Head-to-head-Phase-IIa-Studie mit dem Vergleich des hochselektiven JAK-1/TYK-2-Inhibitors TTL-018 gegen Tofacitinib bei 101 Patienten mit „difficult-to-treat“ RA (mäßig bis schwer aktiv, Versagen auf oder Intoleranz von MTX; ca. 50 % bDMARD- und 30 % JAKi-erfahren). Diese wurden im Verhältnis 1:1:1:1 auf 2x täglich TTL-018 10, 20, 30 mg oder Tofacitinib 5 mg randomisiert. Nach 12 Wochen blieben Patienten mit ACR50-Ansprechen auf ihrer Therapie; gelang dies nicht, wechselten jene auf Tofacitinib und TTL-018 10 mg auf TTL-018 20 mg und jene auf 20 oder 30 mg wechselten oder blieben auf 30 mg.
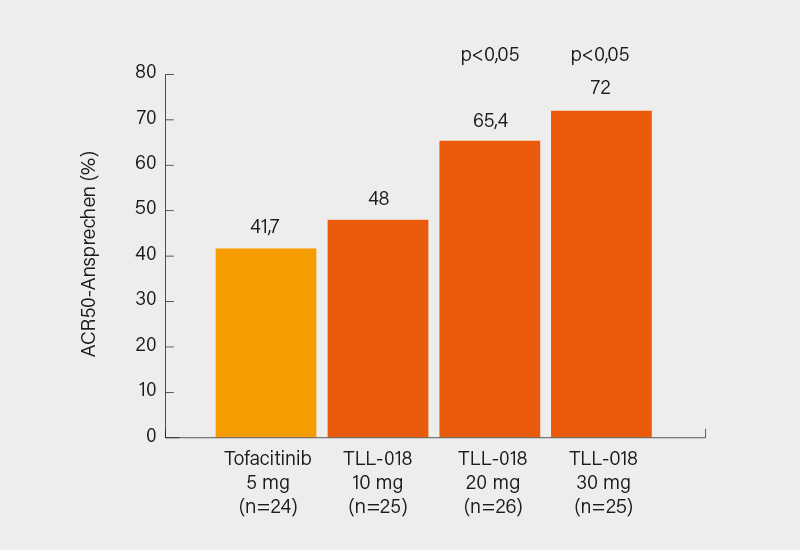
Primärer Endpunkt war das ACR50-Ansprechen in Woche 12. Diesen erreichten unter 10, 20 und 30 mg TTL-018 mehr Patienten als unter Tofacitinib (48,0, 65,4 und 72,0 % vs. 41,7 %; p<0,05 für 20 und 30 mg) (Abb. 2); in der Per-Protokoll-Analyse erreichten unter TTL-018 30 mg 77,3 % einen ACR50! Eine DAS28-Remission <2,6 erreichten nach 12 Wochen 39,4, 34,8 und 54,5 vs. 17,4 % der Patienten. Die 20 und 30 mg-Dosis schnitt auch bei bDMARD- und JAKi-vorbehandelten Patienten sehr gut ab mit einem ACR50-Ansprechen >66 %. Fast unglaubliche 88,9 % der Patienten, die das Therapieziel unter Tofacitinib in Woche 12 verfehlten, erreichten unter TTL-018 ein ACR50-Ansprechen in Woche 24 (man bedenke aber die geringen Fallzahlen). Die Verträglichkeit von TTL-018 war gut, eine weitere Exploration wäre (auch in Europa/den USA) überaus wünschenswert. (7)
Quellen:
1 Ann Rheum Dis 2023; 82 (Suppl 1): 86 (OP0130)
2 Ann Rheum Dis 2023; 82 (Suppl 1): 1 (OP0002)
3 Ann Rheum Dis 2023; 82 (Suppl 1): 24 (OP0038)
4 Ann Rheum Dis 2023; 82 (Suppl 1): 143 (OP0219)
5 Ann Rheum Dis 2023; 82 (Suppl 1): 87 (OP0132)
6 Ann Rheum Dis 2023; 82 (Suppl 1): 148 (OP0225)
7 Ann Rheum Dis 2023; 82 (Suppl 1): 200 (LB0001)