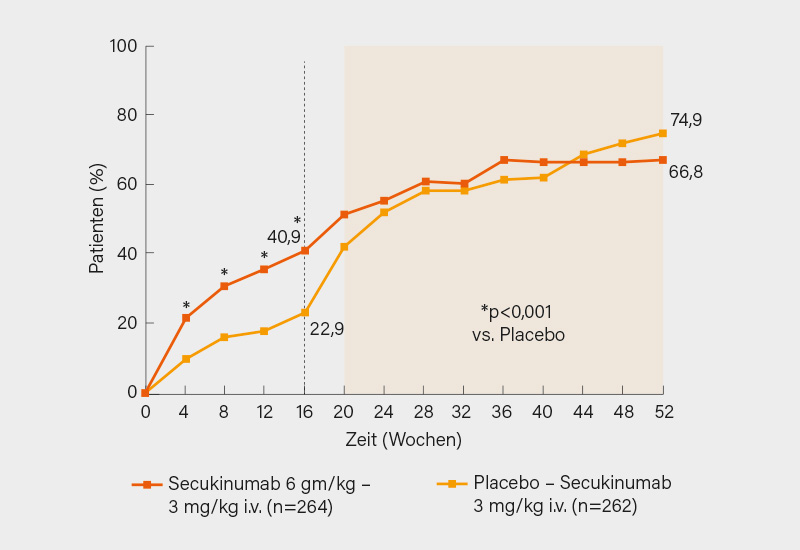
Zunächst zur INVIGORATE-1-Studie, in der 526 Patienten mit aktiver röntgenologischer (r-)axSpA (n=413) oder nicht-röntgenologischer (nr-)axSpA (n=113) (alle Patienten hatten Rückenschmerzen für ≥6 Monate mit Beginn vor dem 45. Lebensjahr; r-axSpA gemäß den modifizierten New York-Kriterien, nr-axSpA gemäß den ASAS-Kriterien und positivem MRT und/oder erhöhtem hsCRP) im Verhältnis 1:1 für 16 Wochen auf i.v. Secukinumab (6 mg/kg zu Baseline, danach 3 mg/kg alle 4 Wochen) oder Placebo randomisiert wurden. Ab Woche 16 wechselten die Placebo-Patienten auf i.v. Secukinumab, die anderen setzten ihre i.v.-Therapie bis Woche 52 fort.
Den primären Endpunkt eines ASAS40-Ansprechen in Woche 16 erreichten unter Secukinumab und Placebo 40,9 vs. 22,9 % der Teilnehmer (p<0,001) (Abb.). Bis Woche 52 erreichten 66,8 bzw. 74,9 % der durchgehend mit i.v. Secukinumab bzw. von Placebo auf i.v. Secukinumab gewechselten Patienten das ASAS40-Kriterium (Abb.). Ein ähnliches Bild zeigte sich auch für die sekundären Endpunkte, so erreichten in Woche 52 unter Secukinumab und Placebo/Secukinumab z. B. 34,4 und 30,9 % eine ASDAS-CRP inaktive Erkrankung sowie 32,3 und 31,9 % eine ASAS partielle Remission, der Rückgang im BASDAI ab Baseline betrug -4,03 bzw. -4,22 Punkte. Die 52-wöchige Behandlung erwachsener axSpA-Patienten mit i.v. Secukinumab erwies sich als effektiv und sicher, das Sicherheitsprofil entsprach der s.c.-Applikation. Die Zulassung der i.v.-Formulierung in den USA erfolgte am 6. Oktober, jedoch dürfte sie nur bei ausgewählten Patienten eine Rolle spielen. (1)
Aktuelle Daten zur TNFα-Blockade
Bei r-axSpA-Patienten sind potenziell positive bDMARD-Effekte auf das kardiovaskuläre (CV) Risiko nur unzureichend erfasst. Anhand einer südkoreanischen Kohorte von 43.502 Patienten mit r-axSpA-Diagnose (ab 2010) und ohne CV-Ereignisse (Myokardinfarkte oder Schlaganfälle) in der Anamnese wurde von Oh Chan Kwon, Seoul (Südkorea), und Kollegen eine bevölkerungsbasierte Studie zum Vergleich des CV-Risikos unter TNFi und IL-17-Inhibitoren (IL-17i) sowie gegenüber keiner bDMARD-Exposition initiiert. Die Inzidenzraten von CV-Ereignissen in Perioden mit bDMARD-Nicht-Exposition, TNFi-Exposition und IL-17i-Exposition betrugen 18,66, 8,92 und 12,87 pro 10.000 Personenjahre. Gegenüber keiner bDMARD-Exposition war die TNFi-Exposition mit einem signifikant niedrigeren CV-Risiko assoziiert (adjustierte Hazard Ratio [HR] 0,697; 95% KI 0,499–0,974), während dies bei IL-17i-Exposition nicht der Fall war (adj. HR 0,958; 95% KI 0,133–6,888). Das Risiko für CV-Ereignisse unterschied sich aber andererseits auch nicht signifikant zwischen IL-17i und TNFi (adj. HR 1,373, 95% KI 0,188–10,029). TNFi senkten somit das CV-Risiko von r-axSpA-Patienten um ca. 30 % und stärker als IL-17i. (2)
Zu guter Letzt zur von Anna Molto, Paris (Frankreich), und Kollegen präsentierten emulierten Zielpunktstudie BioGRIC, in der bei 2.082 Frauen mit Einzelschwangerschaften (1.503 mit axSpA) ein TNFi während der Schwangerschaft weitergeführt (28 %) oder abgesetzt wurde (72 %). TNFi waren nicht mit negativen Einflüssen auf die Schwangerschaft oder den Fötus assoziiert, senkten aber das Risiko für schwere, hospitalisierungspflichtige Infektionen in der und bis zu 6 Wochen nach der Schwangerschaft (0,2 vs. 1,3 %). (3)
Quellen:
1 Arthritis Rheumatol 2023; 75 (Suppl 9): Abstr. 2545
2 ACR Convergence 2023; Late Breaking-Poster L11
3 Arthritis Rheumatol 2023; 75 (Suppl 9): Abstr. 0477