Ustekinumab: MTX ohne Zusatznutzen
Bei aktiver PsA wird MTX oft als First-line-DMARD eingesetzt, dessen Rolle in einer Kombination mit einem bDMARD nach erforderlicher Therapieeskalation ist aber strittig. Deutsche Rheumatologen um Michaela Köhm, Frankfurt/M., designten deshalb ein randomisiertes, placebokontrolliertes Investigator Initiated Trial (IIT) zur Evaluation von Ustekinumab alleine oder in Kombination mit MTX (fortlaufend oder neu initiiert). Ziel war der Nachweis einer Nicht-Unterlegenheit in Bezug auf Arthritis (DAS28 in Woche 24) und der Vergleich der Wirksamkeit auf verschiedene PsA-Domänen. In der Studie wurden 173 Patienten mit aktiver PsA (TJC ≥4, SJC ≥4 und DAS28 ≥3,2) auf Ustekinumab plus MTX (n=87) oder Placebo (n=79) randomisiert mit Stratifizierung bezüglich ihrem vorherigen MTX-Status (MTX-vorbehandelt: verblindete Fortführung oder Austausch gegen Placebo; MTX-naiv: verblindete Initiierung von MTX oder Placebo). 41 % der Patienten waren Frauen, im Mittel ca. 48 Jahre alt, mit einem BMI von 29, SJC 8, TJC 12, DAS28-CRP 4,5, DAPSA 36, PASI 2,6, 50 % mit Enthesitis (LEI ≥0) und etwa 22 % mit Daktylitis. Primärer Endpunkt war ein Nachweis der Non-Inferiorität der Ustekinumab-Monotherapie (mit einer Marge von 12,5 %) bezüglich des DAS28-ESR in Woche 24.
In Woche 24 ging der DAS28-ESR auf 3,1 (MTX) vs. 2,9 (Placebo) zurück, eine Nicht-Unterlegenheit der Ustekinumab-Monotherapie wurde nachgewiesen. Auch bezüglich anderer Parameter wie Psoriasis, Enthesitis oder Daktylitis waren in Woche 24 keine relevanten Unterschiede erkennbar. Innerhalb der Subgruppen beeinflussten weder die Initiierung noch der Entzug von MTX die Effektivität von Ustekinumab, so z. B. im ΔDAPSA bei MTX-vortherapierten Patienten 17,0 (MTX) vs. 15,5 (Placebo) und bei MTX-naiven 20,4 vs. 24,9. Die Kombination mit MTX bot 18 % mehr unerwünschte Ereignisse (UE) und die einzigen schweren Infektionen. Im Falle von Ustekinumab, dessen gute Effektivität in dieser IIT bestätigt wurde, beeinflusste also weder die Zugabe noch der Entzug von MTX dessen Wirksamkeit in puncto Arthritis, Enthesitis, Daktylitis, Haut, Lebensqualität und Funktion. (1) Für IL-17A- und IL-23-Inhibitoren dürfte wohl ähnliches gelten, bei TNFα-Inhibitoren könnte begleitendes MTX eine etwas größere Rolle spielen.
Risankizumab: Update zur IL-23-Inhibition
Nur kurz eingegangen sei auf den IL-23-Inhibitor Risankizumab, der als zweiter Vertreter dieser Substanzklasse nach Guselkumab zur Zulassung bei aktiver PsA ansteht. Evidenz hierfür hatten die auf dem virtuellen EULAR präsentierten 24-Wochen-Daten der Phase-III-Studien KEEPsAKE-1 und -2 geschaffen. Merav Lidar, Ramat Gan (Israel), stellte nun die Daten einer Subgruppenanalyse der randomisierten, doppelblinden, placebokontrollierten KEEPsAKE-2-Studie vor. 443 Patienten mit aktiver PsA (SJC/TJC ≥5) und unzureichendem Ansprechen oder Unverträglichkeit von 1-2 bDMARDs (46,5 %) oder ≥1 csDMARD waren 1:1 auf s.c. Risankizumab 150 mg oder Placebo in Woche 0, 4 und 16 randomisiert worden. Der primäre Endpunkt eines ACR20-Ansprechens in Woche 24 wurde signifikant erreicht (51,3 vs. 26,5 %; p<0,001), ebenso alle sekundäre Endpunkte. Beim Vergleich der Patienten mit und ohne bDMARD-Vortherapie zeigte sich, dass eine frühere bDMARD-Therapie nur das allgemeine Ansprechen, nicht aber den relativen Vorteil von Risankizumab gegenüber Placebo beeinflusste. So betrug das ACR20-Ansprechen ohne/mit bDMARD-Vortherapie 56,3 vs. 36,6 bzw. 45,7 vs. 14,9 %, das PASI 90-Ansprechen 56,5 vs. 11,5 bzw. 53,4 vs. 8,9 %, eine minimale Krankheitsaktivität (MDA) erreichten 31,4 vs. 16,1 bzw. 19,0 vs. 5,9 %. Die geringsten relativen Unterschiede für Risankizumab ohne oder mit bDMARD-Vortherapie zeigten sich im Hinblick auf die Besserung von Haut, Enthesitis und Daktylitis. (2)
Brepocitinib: Neues Therapieprinzip ante portas?
Nachdem die JAK-Inhibition mit Tofacitinib und Upadacitinib Einzug in die PsA-Therapie gehalten hat, steht mit dem TYK-2-Inhibitor Deucravacitinib bereits das nächste tsDMARD in den Startlöchern – die Phase-II-Daten waren ermutigend. Jetzt stellte ein internationales Team um Philip Mease, Seattle (USA), die Daten einer randomisierten, placebokontrollierten Phase-IIb-Studie zu dem oralen TYK-2/JAK-1-Inhibitor Brepocitinib vor, der zuvor bei Plaque-Psoriasis gute Ergebnisse gezeigt hatte. In der Studie wurden 218 erwachsene Patienten mit aktiver PsA mit unzureichendem Ansprechen bzw. Intoleranz von NSAR/DMARDs (stabile csDMARD-Dosis und <30 % mit Anti-TNF-Vortherapie erlaubt) im Verhältnis 2:2:1:2 für 16 Wochen auf 1x täglich Brepocitinib 60 mg, 30 mg, 10 mg oder Placebo randomisiert, danach erfolgte eine 1:1-Umstellung auf Brepocitinib 60 oder 30 mg bis Woche 52. Primärer Endpunkt war das ACR20-Ansprechen in Woche 16.
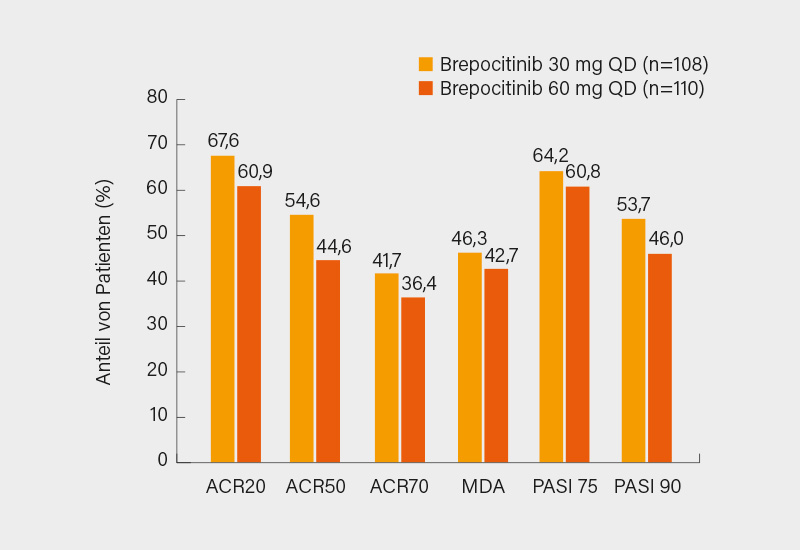
Mit den beiden höheren Brepocitinib-Dosierungen wurde der primäre Endpunkt in Woche 16 mit 66,7 % (30 mg) bzw. 74,6 % (60 mg) versus 43,3 % unter Placebo signifikant erreicht (p<0,05). Selbiges galt für die sekundären Endpunkte ACR50 (48,3 und 44,1 vs. 10,4 %), ACR70 (26,7 und 23,7 vs. 0,7 %), MDA (35,0 und 35,6 vs. 3,0 %) und PASI 90 (33,3 und 53,9 vs. 12,2 %). Das Ansprechen setzte rasch binnen 4 Wochen ein, auch nach 52 Wochen blieben die Verbesserungen erhalten oder steigerten sich noch (Abb.). Auch Lebensqualität und Funktion zeigten sich klar verbessert, eine Resolution von Enthesitis und Daktylitis wurde ebenso häufiger erreicht. Bis Woche 16 zeigte sich ein akzeptables Sicherheitsprofil mit von JAK-Inhibitoren bekannten Effekten wie Herpes Zoster und Laborwertveränderungen (UE waren unter 30 und 60 mg häufiger als unter Placebo). Schwere kardiovaskuläre Ereignisse, venöse Thromboembolien oder Todesfälle traten nicht auf.
Von einer weiteren Evaluation von Brepocitinib in Phase-III ist auszugehen, die 30- und 60 mg-Dosierungen scheinen ähnlich effektiv zu sein, zumindest in Bezug auf Haut und Enthesitis wurde allerdings mit der höheren Dosis schneller ein hohes Ansprechen erzielt. (3)
Quellen:
1 ACR Convergence: Poster L12
2 Arthritis Rheumatol 2021; 73 (Suppl 10): Abstr. 0183
3 Arthritis Rheumatol 2021; 73 (Suppl 10): Abstr. 0488