AAV: Neues zur Induktions- und Erhaltungstherapie
Zunächst zu den Kleingefäßvaskulitiden, über die Prof. Dr. Julia U. Holle, Neumünster, berichtete. Mit einem Blick auf die Leitlinien empfiehlt die DGRh zur Therapie der AAV initial Glukokortikoide (GK) in einer Dosierung von 1 mg/kg/Tag Prednisolon (max. 80 mg/Tag) einzusetzen, bei Bedarf kann 1 g Methhylprednisolon erwogen werden. Schwieriger wird es bei der nicht genau definierten Erhaltungsdosis, genannt werden hier 5-7,5 mg/Tag, und auch zur Deeskalation (falls stabil für ≥24 Monate Therapie individuell und ohne Präferenz einer bestimmten Abfolge ausschleichen) gibt es keine klare Aussage. Die EULAR/ERA-Leitlinie empfiehlt eine identische Initialdosis, bei Remission das Erreichen einer Zieldosis von 7,5-10 mg nach 3 Monaten sowie nach einer Erhaltung für ≥24 Monate zunächst das Absetzen von GK. Die in Studien zu Beginn verwendeten GK-Dosierungen sind jedoch oft höher, was ein wichtiger Grund dafür sein dürfte, dass bei der 1-Jahres-Mortalität Infektionen und nicht die aktive Vaskulitis der wichtigste Treiber sind. Umgekehrt fallen nach Absetzen der Immunsuppression in fast allen hierzu durchgeführten Studien hohe Rezidivraten auf, eine Erarbeitung standardisierter remissionserhaltender Strategien wäre daher dringlich, so Holle.
Ein erster Durchbruch bei der Reduktion von Rezidiven gelang in der MAINRITSAN 1-Studie, in der sich Rituximab gegenüber Azathioprin in der Erhaltungstherapie signifikant überlegen zeigte. Jedoch kam es nach 18 Monaten Rituximab-Therapie im Follow-up ab Monat 48 zu einem deutlichen Anstieg der Rezidivrate („late relapses“), also mit ungefähr 2-jähriger Verzögerung. Laut Holle ist eine komplette Therapiefreiheit in der Mehrzahl der Fälle wohl nicht erreichbar. Die MAINRITSAN 2-Studie zeigte, dass eine ausschließliche Steuerung der remissionserhaltenden Therapie mit Rituximab anhand von ANCA und B-Zell-Zahlen nicht zu empfehlen ist, numerisch kam es gegenüber der fixen Dosierung sogar zu mehr Rezidiven. Take-home-Message der MAINRITSAN 3-Studie (mit Patienten, die am Ende von MAINRITSAN 2 nach 28 Monaten in kompletter Remission waren) war, dass eine Fortführung von Rituximab bis Monat 46 zu einer signifikanten Reduktion der Rezidivrate führte. Angesichts der Reduktion der humoralen Impfantwort wäre wohl eine Streckung der Infusionsintervalle (z. B. Rituximab individuell alle 8-12 Monate) möglich und sinnvoll.
AAV: PEXIVAS, ADVOCATE und neue ACR-Leitlinie
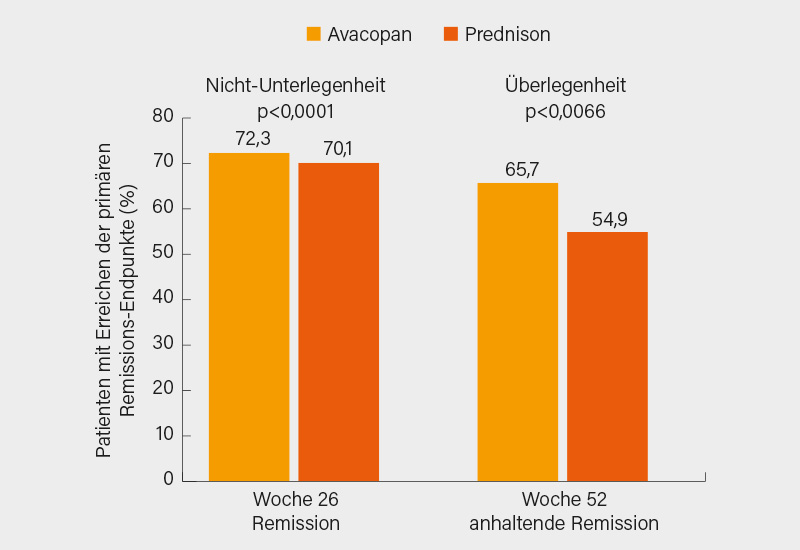
Bedeutsam war die PEXIVAS-Studie zur Remissionsinduktion bei Patienten mit schwerer GPA/MPA (eGFR <50 ml/min.): Zusätzlich zu einer Standardinduktion mit Cyclophosphamid (CYC) oder Rituximab brachte eine frühe Plasmapherese nach 6 Jahren keinen Vorteil beim primären Endpunkt aus Tod und Nierenversagen (36 vs. 41 %; p=0,27). Positiv war, dass sich eine raschere Reduktion der GK-Dosis (auf 10 statt 20 mg in Woche 11) gegenüber der GK-Standardreduktion nicht negativ auf den primären Endpunkt in Jahr 6 auswirkte (42 vs. 35 %), aber bei gleicher Wirksamkeit das Infektionsrisiko reduzierte. Das Low-dose GK PEXIVAS-Protokoll sollte neuer Standard in der Induktion bei GPA/MPA sein und sei in der Praxis gut durchführbar, eine Reduktion auf 5-7,5 mg/Tag nach 3-4 Monaten realistisch, so Holle. Bemerkenswert ist auch die Phase-III-Studie ADVOCATE, in der 331 Patienten mit akuter AAV auf den oralen Komplement C5a-Rezeptorinhibitor Avacopan oder Prednison randomisiert wurden. Beide Therapiearme erhielten zusätzlich CYC oder Rituximab zur Remissionsinduktion, gefolgt von Azathioprin. Beide primären Endpunkte wurden erreicht: eine Remission in Woche 26 und anhaltende Remission in Woche 52 gemäß einem BVAS =0 und keine GK-Therapie für ≥4 Wochen. So wiesen 72,3 vs. 71,0 % der Patienten in Woche 26 unter Avacopan bzw. Prednison eine Remission und in Woche 52 65,7 vs. 54,9 % eine anhaltende Remission auf (Abb. 1). Jedoch waren die Remissionsraten eher niedrig und überdies war auch im Avacopan-Arm ein GK-Gebrauch teilweise gestattet und nicht komplett vermeidbar. Avacopan bietet damit sehr wohl die Möglichkeit einer GK-Einsparung, genauere Protokolle zu dessen Anwendung und Optimierung der Remissionsrate müssen aber erst noch erarbeitet werden.
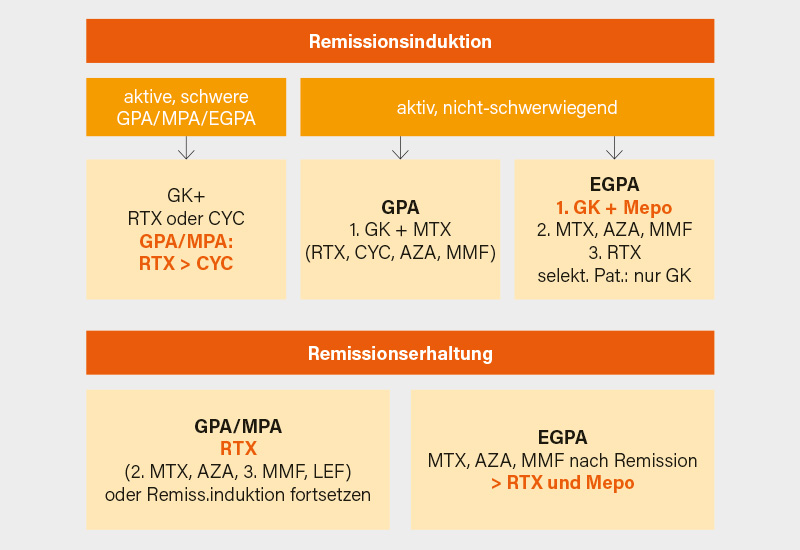
Abschließend ging Holle noch auf die Kernaussagen bzw. Neuerungen der kürzlich publizierten ACR/Vasculitis Foundation (VF)-Leitlinie (Abb. 2)ein. Durchaus innovativ sei trotz fehlender Daten zu einer Überlegenheit im Hinblick auf die Remissionsraten, dass bei GPA und MPA in der Remissionsinduktion bedingt Rituximab gegenüber CYC bevorzugt wird. Bei Patienten mit aktiver schwerer GPA/MPA wird als Konsequenz aus PEXIVAS bedingt eine reduzierte gegenüber der Standard-GK-Dosis favorisiert und man spricht sich wiederum bedingt eher gegen eine Plasmapherese in der Remissionsinduktion aus. Bezüglich der remissionserhaltenden Therapie wird Rituximab – auch dies ist nach den MAINRITSAN-Studien nachvollziehbar – bedingt gegenüber Methotrexat bzw. Azathioprin favorisiert. Eine Re-Therapie mit Rituximab soll präferentiell anhand eines definierten Zeitschemas und nicht auf Basis des ANCA-Titers oder der B-Zell-Zahlen festgelegt werden. Zur Dauer der Erhaltungstherapie (mit Immunsuppressiva bzw. GK) gibt es nur ein Positions-Statement: Zwar wird eine Dauer ≥18 Monate und potenziell noch länger vom Expertenpanel präferiert, jedoch soll dies individuell am klinischen Status und Patientenpräferenzen festgemacht werden. Begrüßenswert ist laut Holle, dass bei „nicht-schwerer“ EGPA das in Europa vor der Zulassung stehende Mepolizumab zur Remissionsinduktion empfohlen wird, fraglich erscheint, warum es nur einen geringen Stellenwert in der Remissionserhaltung zugebilligt bekam.
RZA: Was sind wichtige Punkte der ACR-Leitlinie?
Über die Neuigkeiten bei den Großgefäßvaskulitiden seit der Veröffentlichung der EULAR- als auch DGRh-Leitlinie referierte im Anschluss Prof. Dr. Bernhard Hellmich, Kirchheim/Teck. Ähnlich wie bei AAV ist auch bei der RZA das Mortalitätsrisiko insbesondere im ersten Jahr nach der Diagnosestellung erhöht, wobei (zusätzlich zu endokrinen, kardiovaskulären und gastrointestinalen Komplikationen) wiederum insbesondere Infektionen eine wichtige Rolle spielen – die Therapie mit GK ist also auch hier mit einer erhöhten Gefährdung verbunden. Zu beachten ist auch der Phänotyp, denn bei prädominant kranieller RZA führt eine aortale Beteiligung, zu deren Beurteilung MRT, CT oder PET-CT eingesetzt werden können, doch zu vermehrten Gefäßkomplikationen und erhöhter Mortalität. So ergab eine retrospektive Studie mit 171 RZA-Patienten bei Erstdiagnose in 40 Fällen aortale Komplikationen (meist Aneurysmen), im Follow-up über 3 Jahre kamen 24 neue Fälle hinzu. Als Risikofaktoren sind nach einer Studie Aortitis-Symptome zu nennen (Hazard ratio, HR 6,64 bei Diagnose, und HR 3,62 bei Rezidiv), einer anderen Studie zufolge ist damit vor allem bei Männern (HR 2,10) und öfter bei isolierter Aortitis versus RZA und TAK (58 vs. je ca. 20 %) zu rechnen.
Der nächste Punkt war ein Vergleich der EULAR- bzw. DGRh- mit der neuen ACR-Leitlinie. Bei weitgehender Übereinstimmung gibt es doch einige wichtige Unterschiede, die aber teils durch nationale Besonderheiten erklärbar sind. Anders als DGRh/EULAR präferiert der ACR die Biopsie gegenüber dem Ultraschall (MRT), was an weniger Erfahrung mit dem Ultraschall in den USA liegen dürfte. Eine negative Biopsie wird dort als Voraussetzung zur Bildgebung (PET-CT, CT, MRT) extrakranieller Gefäße gesehen, bei gesicherter Diagnose werden diese Verfahren aber vom ACR empfohlen (DGRh/EULAR: „kann erwogen werden“). DGRh und EULAR empfehlen zu Therapiebeginn (ohne Visusstörung) eine GK-Dosis von 40-60 mg/Tag, während sich der ACR für 1 mg/kg (max. 80 mg/Tag) ausspricht. Während DGRh und EULAR den Einsatz von Tocilizumab bei Patienten mit vorhandenen oder Risikofaktoren für GK-assoziierte Folgeschäden empfiehlt, gewichtet der ACR die GK-Toxizität höher und rät bei RZA-Erstdiagnose generell zu einer Steroideinsparung mit Tocilizumab. Schwächer fällt hierzu beim ACR im Vergleich die Empfehlung für MTX aus („kann erwogen werden“). Während DGRh und EULAR im Falle einer extrakraniellen Beteiligung keine speziellen Empfehlungen geben, rät der ACR zum Einsatz von Tocilizumab (falls nicht möglich MTX). Im Falle eines Rezidivs unter GK-Monotherapie wird vom ACR eindeutig zu Tocilizumab geraten, da der GK-sparende Effekt gegenüber MTX als höher eingeschätzt wird. Während DGRh und EULAR bei der GK-Reduktion eine Zieldosis von 10-15 mg/Tag nach 3 Monaten und ≤5 mg/Tag nach 1 Jahr ausgeben, verzichtet der ACR auf solche Vorgaben. ASS wird vom ACR bedingt bei Fluss-limitierender Beteiligung der Aorta carotis oder A. vertebralis empfohlen, von DGRh und EULAR nur, falls aus anderen Gründen indiziert.
RZA: Tocilizumab, Bildgebung und neue Therapien
Laut DGRh sollte unter einer Therapie mit Tocilizumab eine schnellere Reduktion der GK-Dosis im Vergleich zu einer GK-Monotherapie erfolgen. Der Frage, ob bei einem Einstieg mit Tocilizumab nicht (fast) ganz auf GK verzichtet werden kann, beantwortete die Pilotstudie GUSTO, in der nach 3 Tagen Methylprednisolon nur noch Tocilizumab (erst 8 mg/gk i.v. an Tag 3, dann s.c. 162 mg/Woche bis Tag 52) gegeben wurde (n=18). Der primäre Endpunkt einer Remission in Woche und bis Woche 24 wurde verfehlt, erst nach 11 Wochen hatten 78 % der Patienten eine Remission erreicht. Auch in einer noch kleineren Studie (n=8), in der nach RZA-Erstdiagnose nur Tocilizumab eingesetzt wurde, belegt einen zeitverzögerten Effekt (erst in Woche 24 75 bzw. 25 % mit voller oder partieller Remission). Laut Hellmich wird frühestens ab Woche 8 (bis 12) der volle Wirkspiegel erreicht, sodass zumindest in der initialen Phase nicht völlig auf GK verzichtet werden kann.
Die DGRh-Empfehlung, dass bei anhaltender Remission eine Deeskalation oder Beendigung der GK-einsparenden Therapie erfolgen sollte, wirft ferner die Frage auf, wann Tocilizumab gestoppt werden kann. Auch auf Basis einer GiACTA-Subgruppenstudie lässt sich dies nicht eindeutig beantworten, denn in ca. 50 % der Fälle muss 1 Jahr nach dem Stopp von Tocilizumab mit einem Rezidiv gerechnet werden. Da im Langzeitverlauf keine neuen Sicherheitssignale auftraten, könnte eine Intervallverlängerung von Tocilizumab eine potenzielle Option sein – hierzu bedarf es entsprechender Strategiestudien zur Deeskalation. Interessant ist, dass in GiACTA eindeutige Risikofaktoren für ein Therapieversagen nur für die GK-Monotherapie (Frauen mit 5-fach höherem Risiko!), nicht aber Tocilizumab nachweisbar waren.
Interessant ist eine neue Arbeit, die darauf hinweist, dass die Farbduplexsonografie der A. temporalis und A. axillaris mit Bestimmung der Summe aller Segmente mit Halo sowie der Halo-Intima media Dicke (IMD) zu definierten Zeitpunkten recht gut zur Verlaufskontrolle der Entzündungsaktivität geeignet ist. Unter Therapie zeigte sich ein deutlicherer Rückgang der Aktivität an der A. temporalis gegenüber der A. axillaris. Bei hoher Zahl von A. temporalis-Segmenten mit Halo sank signifikant die Wahrscheinlichkeit einer Remission (Odds ratio, OR 0,39). Auch im Verlauf fanden sich Halo-Zeichen bei 94 % der Patienten, aber weniger als bei Erstdiagnose. In der GUSTO-Studie zeigte sich mit diesem Verfahren ein rascher Abfall der IMD unter i.v.-GK, währen dieser Effekte unter Tocilizumab erst zeitverzögert auftrat. Recht gut abbilden ließ sich ein Rückgang der Aktivität unter Tocilizumab im PET-CT (alle 6 Monate) mit dem PETVAS-Score, ebenso eine Zunahme nach dessen Absetzen. Ein solcher Nachweis gelang in einer weiteren PET-CT-Studie auch bei extrakranieller RZA, wobei der Aktivitätsrückgang unter Tocilizumab und MTX plus GK stärker als unter einer Monotherapie mit GK ausgeprägt war. Vor allem der Ultraschall könnte künftig in der Praxis hilfreich sein.
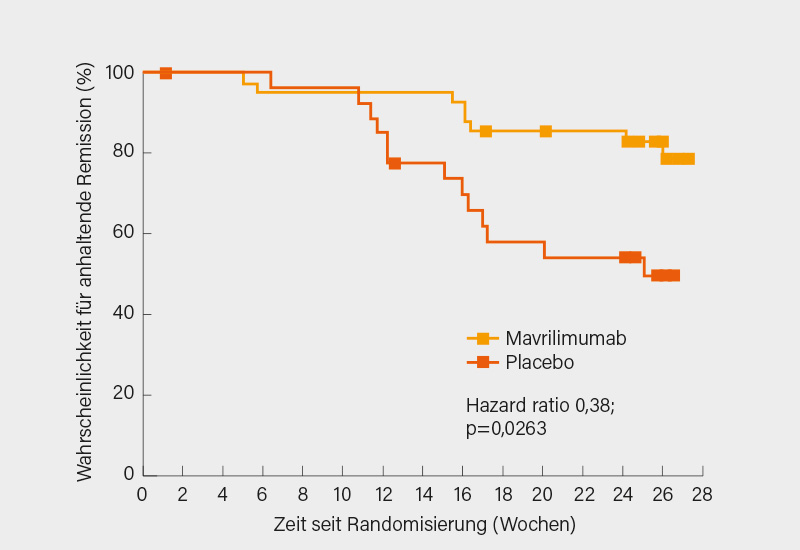
Zur RZA-Therapie werden jenseits einer Head-to-head-Studie zwischen Tocilizumab und MTX derzeit Sarilumab, Anakinra und Upadacitinib in Phase-III-Studien geprüft. Auf eine solche ist auch für den Granulozyten-Makrophagen-Kolonie-stimulierenden Faktor (GM-CSF)-Rezeptorinhibitor Mavrilimumab zu hoffen. In einer Phase-II-Studie mit RZA-Patienten (Erstdiagnose oder Rezidiv) gelang mit diesem versus Placebo (jeweils plus GK) nach 26 Wochen häufiger das Erreichen einer anhaltenden Remission bis Woche 26 (83,2 vs. 49,9 %; p=0,004) und es kam seltener zu Rezidiven (19,0 vs. 26,4 %; p=0,026). Der primäre Endpunkt, die Zeit bis zum ersten Rezidiv, wurde signifikant erreicht (Abb. 3). Ein Pluspunkt von Mavrilimumab wäre, dass anders als bei Tocilizumab CRP und/oder BSG im Rezidiv erhöht und somit als Biomarker einsetzbar sind.
Kaum Neues zur Takayasu-Arteriitis
Keine relevanten Neuigkeiten konnte Hellmich zur TAK vermelden. Zwar wurden eine ganze Reihe kleinerer Fallserien publiziert, an qualitativ hochwertigen Studien fehlt es aber. Auch hier lohnt ein kurzer Blick auf die Unterschiede der DGRh- und EULAR- zur ACR-Leitlinie. Während letztere bei GK-refraktären TAK-Patienten aufgrund mehr Erfahrungen TNFα-Inhibitoren Vorrang gegenüber Tocilizumab einräumt, das in einer unterpowerten Phase-III-Studie den primären Endpunkt verfehlte, stehen beide Substanzklassen bei DGRh und EULAR auf der gleichen Stufe. Ein regelmäßiges Monitoring mittels Bildgebung empfiehlt nur der ACR, als geeignete Verfahren werden CT, PET-CT und MRT aufgelistet. Den Ultraschall empfehlen zusätzlich EULAR und DGRh, in der deutschen Leitlinie wird das MRT gegenüber CT und PET-CT aufgrund deren Strahlenbelastung favorisiert.
Quelle: Sessions „WIN Vaskulitis“ und „Cortisonfreie Rheumatologie? Deeskalationsstrategien und glukokortikoidfreie Therapieregimes“; DGRh-Kongress, 18. September 2021