Wichtigster Baustein im Therapiemanagement sind zu Beginn hochdosierte Kortikosteroide, die oft mit verschiedenen Immunsuppressiva zum Einsatz kommen. Bei unzureichendem Ansprechen kommen auch Ciclosporin, Tacrolimus, Mycophenolat Mofetil, Rituximab, Cyclophosphamid oder IVIG in Frage. Speziell als adjuvante Therapie bei DM schon lange eingesetzt, war die Evidenz für die Behandlung mit IVIG aus kontrollierten Studien bislang begrenzt.
Die bislang fehlende Evidenz generierte nun die von Rohit Aggarwal, Pittsburgh (USA), präsentierte internationale, randomisierte, doppelblinde, placebokontrollierte Phase-III-Studie ProDERM mit zwei Abschnitten (16 bzw. 24 Wochen) zur Effektivität und Sicherheit von IVIG (Octagam 10 %) bei Patienten mit einer aktiven DM.
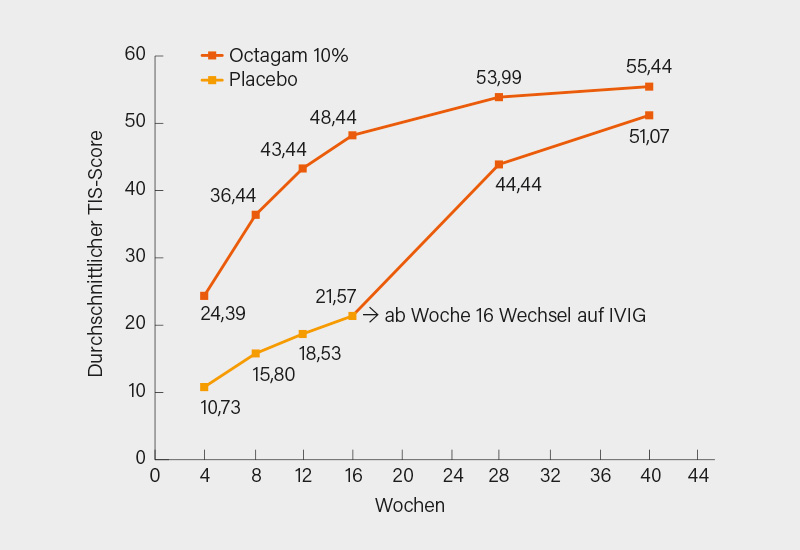
In ProDERM wurden 95 Patienten (im Mittel 53 Jahre, 75 % Frauen) mit gesicherter oder mutmaßlicher DM gemäß den inzwischen veralteten Bohan und Peter-Kriterien und aktiver Erkrankung gemäß einem manuellem Muskeltest-8 (MMT-8)-Score <142/150 im Verhältnis 1:1 auf IVIG oder Placebo randomisiert. Bei einer klinischen Verschlechterung erfolgte ein Wechsel des Therapiearms zwischen Woche 8 und 16. Nach Woche 16 wurden alle Patienten auf Placebo und jene ohne eine klinische Verschlechterung unter der IVIG-Therapie in der Open-label-Extensionsphase für (weitere) 24 Wochen mit 2 g/kg IVIG-Infusionen alle 4 Wochen behandelt. Primärer Endpunkt war in Woche 16 der Anteil von Respondern (IVIG versus Placebo) nach den ACR/EULAR-Ansprechkriterien aus 2016 mit einer minimalen Verbesserung im Total Improvement Score (TIS) um ≥20 Punkte und ohne klinische Verschlechterung bei 2 konsekutiven Visiten.
Primärer Studienendpunkt signifikant erreicht
Den primären Endpunkt in Woche 16 erreichten signifikant mehr der mit IVIG als Placebo behandelten Patienten (78,7 vs. 43,8 %; p=0,0008). Die Zeit bis zum Ansprechen war unter IVIG signifikant kürzer als unter Placebo (median 35 vs. 115 Tage). Die Differenz in der Ansprechrate zugunsten der IVIG-Therapie war noch größer, wenn eine moderate (TIS ≥40: 68,1 vs. 22,9 %; p<0,0001) oder deutliche Verbesserung (TIS ≥60: 31,9 vs. 8,3 %; p<0,0062) angelegt wurde. Auch der mittlere TIS in Woche 16 war unter der IVIG-Therapie signifikant höher (48,4 vs. 21,6) (Abb.). Der Anteil von Respondern im TIS war am Ende der Open-label-Extension (in Woche 40) nach dem Wechsel auf die IVIG in beiden Armen vergleichbar (71,1 bzw. 69,6 %), selbiges galt für den mittleren TIS in Woche 40 (55,4 bzw. 51,1) (Abb.). Andere sekundäre Endpunkte wie der MMT-8, HAQ und der Cutaneous DM Disease Activity Area and Severity Index (CDASI) wurden unter der IVIG-Therapie ebenfalls signifikant erreicht.
In puncto Sicherheit und Verträglichkeit gab es keine neuen Signale, zu therapieassoziierten unerwünschten Ereignissen (TEAE) kam es bei 65,3 % der Patienten (am häufigsten waren Kopfschmerzen, Fieber und Übelkeit). Schwere TEAE traten bis Woche 16 bei 5,8 bzw. 4,2 % der Patienten unter IVIG und Placebo auf. Damit wurde erstmals auch in einer großen randomisierten, kontrollierten Phase-III-Studie der Nachweis einer guten Effektivität und Sicherheit von IVIG bei Patienten mit aktiver DM erbracht.
Quelle: Ann Rheum Dis 2021; 80(Suppl1): 4-5 (OP0008)