Systemischer Lupus erythematodes
Mit Anifrolumab, einem gegen den Anti-Typ-1-Interferon-Rezeptor gerichteten monoklonalen Antikörper wurde im März 2022 ein zweites Biologikum für die Behandlung des SLE zugelassen. Hierzu gab es auf dem EULAR keine neuen Daten, die nicht schon in den letzten Jahren hier vorgestellt wurden. Zu Voclosporin (VCS), einem Calcineurin-Inhibitor, mit dessen Zulassung zur Therapie der Lupusnephritis (LN) auch dieses Jahr noch gerechnet wird, gab es eine deutsche Post-hoc-Analyse. Am meisten Aufsehen erregte aber die Erlanger Arbeitsgruppe um Georg Schett mit dem Einsatz von CD19-CAR-T-Zellen bei 5 hochaktiven SLE-Patientinnen.
BTK- und TYK2-Inhibitoren
Es gibt schon eine lange Liste „gescheiterter“ Substanzen beim SLE, darunter auch die Januskinase (JAK)-Inhibitoren Tofacitinib und Baricitinib (1, 2) sowie die Inhibitoren der Bruton‘schen Tyrosinkinase (BTK) Fenebrutinib (3) und Evobrutinib (4). Ob ein weiterer BTK-Inhibitor, Orelabrutinib (5), oder der Tyrosinkinase (TYK)-2 Inhibitor Deucravacitinib (6) sich da einreihen, bleibt abzuwarten. Auch wenn es zu den beiden Phase-II-Studien auf dem EULAR 2022 jeweils einen „Late breaking abstract“ gab, muss dies kein gutes Omen sein. Dies war für Baricitinib, Fenebrutinib und Evobrutinib auch schon der Fall.
Voclosporin bei LN
VCS ist ein Immunsuppressivum, das für den Einsatz bei Organtransplantationen und Autoimmunerkrankungen „designt“ wurde. Es ist ein Analogon von Ciclosporin (CSA) mit einer stärkeren Calcineurin-Inhibition und vor allem einer verbesserten Pharmakokinetik, die zu stabileren Wirkspiegeln führt. Außerdem soll es in der Langzeitanwendung nicht so nephrotoxisch sein wie CSA.
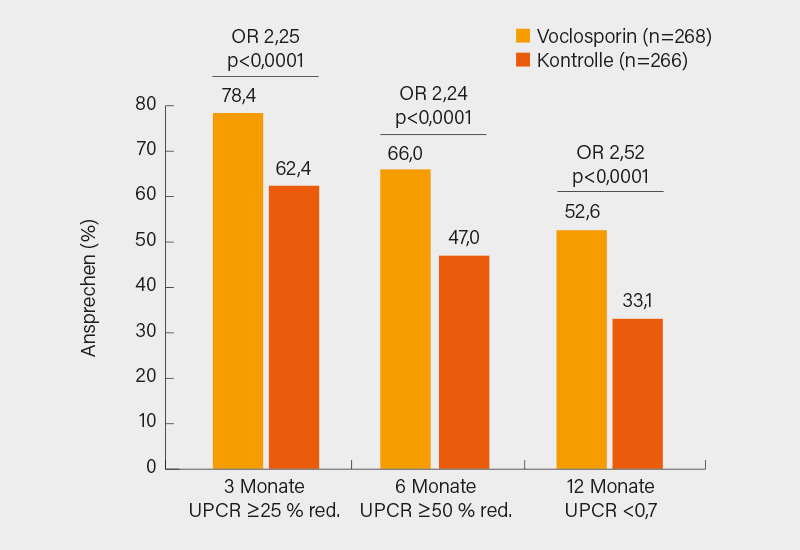
Eine aggregierte Post-hoc-Analyse der Phase-II-Studie AURA-LV und der Phase-III-Studie AURORA (7), welche schon zur Zulassung von VCS in den USA geführt hat, wurde von H. J. Anders aus München vorgestellt. (8) In der AURORA-Studie erhielten die Patienten neben einer Standard-Immunsuppression mit Mycophenolat Mofetil (MMF, 2x 1g) und Glukokortikoiden, die aber recht schnell zu reduzieren waren, entweder 2x täglich 23,7 mg VCS p.o. oder Placebo (PBO). Der primäre Endpunkt einer renalen Response zu Woche 52 wurde unter zusätzlicher Gabe von VCS (n=179) mit fast 41 % deutlich häufiger erreicht als unter alleiniger Gabe von MMF (n=178) mit 22,5 %. Von den 534 SLE-Patienten beider Studien erhielten 268 MMF und VCS und 266 MMF und PBO. Eine Besserung der renalen Eiweißausscheidung (UPCR) um ≥25 % nach 3 Monaten, um ≥50 % nach 6 Monaten und eine UPCR von ≤0,7 nach 12 Monaten wurde unter zusätzlicher Gabe von VCS jeweils signifikant häufiger erreicht als unter einer MMF-Monotherapie (Abb. 1), wobei auch der Steroidbedarf unter VCS geringer war als in der PBO-Gruppe.
In der offenen Verlängerung der AURORA-Studie über insgesamt 3 Jahre wurde VCS gut vertragen, es gab keine unerwarteten Sicherheitssignale bei stabiler eGFR und die in der Doppelblindphase erreichte Verringerung der Proteinurie blieb erhalten. (9)
CAR-T-Zelltherapie bei SLE
Viel Beachtung fand der Vortrag von Georg Schett zum Einsatz von sog. Chimären Antigenrezeptor-T (CAR-T)-Zellen zur Therapie des SLE. Der weltweit ersten in Erlangen so behandelten Patientin (10) sind inzwischen 4 weitere gefolgt. (11)
Bei der CAR-T-Zelltherapie werden körpereigene T-Zellen ex-vivo gentechnisch so verändert, dass sie ein definiertes Antigen, in diesem Fall CD19 auf B-Zell-Oberflächen, erkennen und damit nach i.v.-Gabe in den Patienten zur Lyse CD19-positiver B- und Plasmazellen führen. Da es sich bei CAR-T-Zellen um körpereigene Zellen handelt, vermehren sich diese Zellklone in vivo noch eine Zeit lang weiter, was sie zu einer hochwirksamen Behandlung von zuvor refraktären CD19-positiven B-Zell-Neoplasien machte. Dieses sehr spezielle Therapieverfahren wurde für bestimmte Fälle solcher Neoplasien zugelassen und wird aufgrund des hohen Aufwandes und nicht unerheblicher immunologischer „Nebenwirkungen“ bislang nur an ausgesuchten universitären hämatologischen Zentren durchgeführt.
Die Erlanger Kollegen haben mit den dortigen Hämatologen solche CD19-modifizierte CAR-T-Zellen erstmals bei einer 20-jährigen Patientin mit schwerem therapierefraktären SLE eingesetzt. Nach Leukapherese zur Gewinnung der T-Zellen und vorbereitender Lymphozytendepletion mittels Fludarabin und Cyclophosphamid (CYC) wurden die dann für die CD19-Erkennung modifizierten CAR-T-Zellen der Patientin wieder verabreicht.
Nach der Infusion nahm der Anteil der CAR-T-Zellen von 0,3 % aller peripheren T-Zellen am Tag 3 auf 27,7 % am Tag 9 zu, um dann wieder langsam abzufallen. Bis 7 Wochen nach der Gabe waren aber noch CAR-T-Zellen nachweisbar. Dieser Expansion der CAR-T-Zellen folgte eine vollständige und anhaltende Depletion zirkulierender B-Zellen und es kam innerhalb weniger Wochen zu einem Abfall der dsDNA-Antikörper, Normalisierung der Complementfaktoren und einer klinischen Remission mit einem Rückgang der Proteinurie (uPCR) von >2 auf <0,25. Unerwünschte Effekte hämatologischer CAR-T-Zelltherapien wie Notwendigkeit von Immunglobulinsubstitution bei zu starkem IgG-Abfall, Zytokinfreisetzungssyndrom, neurotoxische Nebenwirkungen oder verlängerte Zytopenien traten bei der behandelten SLE-Patientin nicht auf.
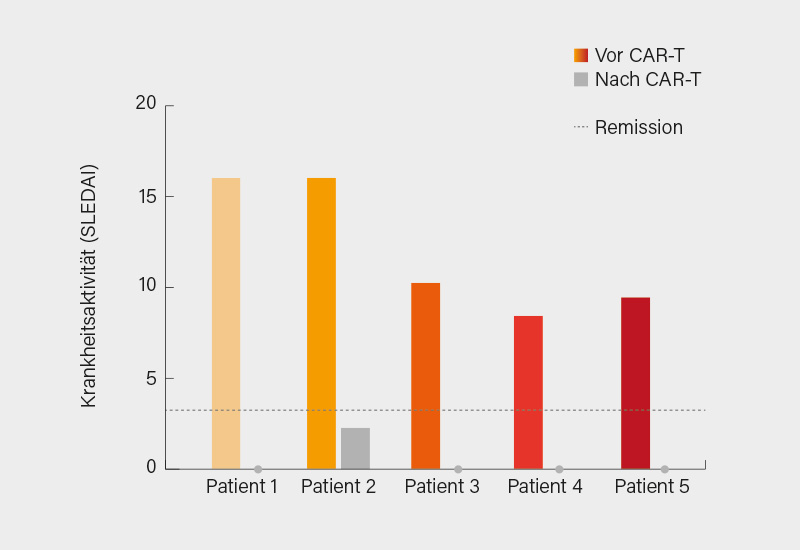
In Kopenhagen konnte Schett nun von bereits 5 so behandelten SLE-Patienten berichten (4 weiblich, Alter 20-24 Jahre, alle mit aktiver LN). Alle entwickelten Fieber ohne Eintreten einer Infektion, ein Patient erhielt einmalig Tocilizumab wegen eines Zytokinfreisetzungssyndroms. Es kam bei allen zu einer vollständigen und anhaltenden Depletion zirkulierender B-Zellen und zu einer Expansion der CAR-T-Zellen auf max. 28-59 % aller zirkulierender T-Zellen am Tag 9. Dann nahmen die CAR-T-Zellen langsam über Monate ab. Die hohe klinische Aktivität vor der Therapie ging nach der CAR-T-Zelltherapie bei allen Patienten drastisch zurück (Abb. 2).
Autoimmune Myositiden
Myositis-spezifische oder -assoziierte Antikörper
Auf dem EULAR gab es mehrere Abstracts zu den (teilweise neuen) Myositis-assoziierten bzw. Myositis-spezifischen Autoantikörpern, die mittels Immunoblot bzw. Line-Blot bestimmt werden können. Eine italienische Gruppe analysierte 294 Anforderungen von Myositis-spezifischen Antikörpern (MSA) zwischen dem 1.1.2019 und 31.12.2020. (12) 20,4 % wiesen im Line-Blot positive MSA auf, 3,1 % gleich mehrere. Eine interstitielle Lungenerkrankung (ILD) war die häufigste extra-muskuläre Manifestation und die Pneumologen waren mit 41 % auch die am häufigsten registrierte Fachrichtung unter den Einsendern. Aus der Rheumatologie kamen 24 % aller Anforderungen und diese wiesen mit 39 % positiven Befunden den höchsten Anteil positiver MSA auf. Häufigster MSA war der PM-Scl-100 kD Antikörper, wobei betont werden muss, dass Antikörper gegen Jo-1 und z. B. auch u1RNP schon im einfachen ELISA-Test erfasst werden und dann kein Anlass mehr besteht, nach weiteren MSA mittels Line-Blot zu fahnden. Eine ähnliche Untersuchung von 267 Untersuchungen im Myositis-Line-Blot ergab im Zeitraum 03/2017 bis 03/2021 44 % MSA-positive Fälle, wovon 13 % mehrere MSA aufwiesen. (13) In dieser Untersuchung waren Mi-2-Antikörper mit 24 % am häufigsten zu finden, gefolgt von Pm-Scl-Antikörpern mit 17 %. In einer dritten Analyse von 130 Patienten mit MSA im Line-Blot der Jahre 2018-2020 (14) wies ein Drittel eine autoimmune Myositis auf, ein Drittel andere Autoimmunerkrankungen (mit Muskelbeteiligung) und bei wiederum einem Drittel fanden sich keine Hinweise für eine entzündliche Muskelaffektion. Somit waren 51 % der Befunde richtig positiv und 49 % falsch positiv. Fehlende oder nur niedrig-titrige ANA, nur schwach-positive Banden im Line-Blot und der Nachweis mehrerer MSA waren mit falsch positiven MSA-Befunden assoziiert.
Antikörper gegen MDA-5 (Melanoma differentiation-associated gene 5) sind mit einer schweren, oft amyopathischen Dermatomyositis (DM) und schlechter Prognose assoziiert, vor allem aufgrund der Neigung zu einer rasch-progredienten ILD. Dies bestätigte eine Untersuchung aus Schweden von 28 Anti-MDA-5-positiven Patienten in 22 Jahren. (15) Von 19 auswertbaren Fällen wiesen 84 % eine ILD auf, wovon 25 % rapid progressiv verliefen. Ein Patient verstarb und einer erhielt eine Lungentransplantation. Ein CRP über dem 3-fachen des oberen Normwertes wiesen 89 % der Patienten mit einer FVC <70 % auf, im Vergleich zu nur 17 % bei einer FVC >70 % (p=0,01).
JAK-Inhibition bei Anti-MDA-5-positiver DM
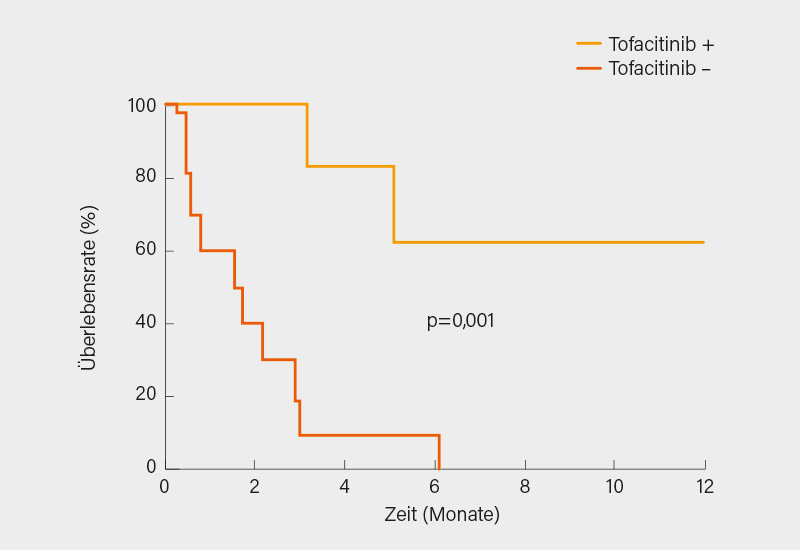
Über einen eventuell positiven Einfluss der JAK-Inhibition mit Tofacitinib bei Anti-MDA-5-positiver DM berichteten zwei asiatische Arbeitsgruppen. In Taiwan (16) wurden 6 von 17 Patienten mit rapid-progressiver ILD und Anti-MDA-5-Antikörpern nach erfolglosem Einsatz von CYC, MMF, Calcineurin-Inhibitoren, Immunglobulinen und Rituximab mit Tofacitinib behandelt und wiesen darunter eine deutlich bessere Überlebensrate auf als die anderen Patienten (Abb. 3).
Aus Japan kam eine zweite Fallkohorte. (17) Dort wurden in 7 Jahren (2014-2021) 31 Patienten mit MDA-5-Antikörpern identifiziert. Von 17 Patienten, die vor der Einführung von Tofacitinib mit Rituximab, Plasmapherese oder intravenösen Immunglobulinen behandelt worden waren, sind 8/10 mit einer rapid-progressiven ILD nach durchschnittlich 2,5 Monaten verstorben. Nach Verfügbarkeit von Tofacitinib erhielten 8 Patienten erst Methyl-Prednisolon, Rituximab und Plasmapherese als Induktions- und danach Tofacitinib als Erhaltungstherapie. Von diesen sind bislang „nur“ zwei verstorben. Schlechte Prognosefaktoren (außer der ILD selbst) waren die Seromarker CK, LDH, CRP und Ferritin.
Fazit: ANA ist weiterhin als Screeningtest geeignet, Anti-Synthetase-Syndrome haben aber oft nur ein zytoplasmatisches Muster. Bei klinischem Verdacht (CK, interstitielle Lungenerkrankung) und fehlender Identifizierung im Enzymimmunassay (Anti-Jo-1?) findet man im Immunoblot (Line-Blot) in ca. 40 % der Fälle spezifische Antikörper (MSA) mit z. T. prognostischer Bedeutung. Vorsicht ist bei schwach positiven Befunden und multiplen Myositis-spezifischen/-assoziierten Antikörpern geboten. Ein isolierter Ro52-Antikörper ist meist unspezifisch. Anti-MDA-5-Antikörper sind selten, aber mit einer schlechten Prognose assoziiert, insbesondere aufgrund einer rasch-progredienten ILD. Schlechte serologische Prognosefaktoren bei autoimmunen Myositiden sind CK, LDH, CRP und Ferritin. Bei Anti-MDA-5-positiver DM könnte eine JAK-Inhibition mit Tofacitinib wirksam sein.
Systemische Sklerose
Biomarker und Prognoseparameter
Wie an dieser Stelle mehrfach betont, stellt die ILD bei der diffusen Form der SSc das klinische Hauptproblem aufgrund der hiermit assoziierten Mortalität dar. In einer Analyse der Placebogruppe der SENSCIS-Studie, die also kein Nintedanib zur Beeinflussung einer SSc-ILD erhielt, wiesen die Patienten, welche MMF als Hintergrundmedikation einnahmen, eine geringere ILD-Progressionsneigung auf. (18)
In einer Analyse aus dem EUSTAR-Register hatten Patienten mit persistierender CRP-Erhöhung ein stark erhöhtes Mortalitätsrisiko (Hazrad ratio, HR 7,1; p<0,001) (19) und in einer Post-hoc-Analyse der Scleroderma Lung Study 2 (SLS II) war eine Absenkung erhöhter CRP-Werte zum einen deutlicher unter MMF zu verzeichnen als unter CYC und auch mit einem besseren FVC-Verlauf assoziiert. (20) In einer deutschen Studie schien ein löslicher Interleukin-2-Rezeptor (sIL-2R) von über 745 U/ml ein Prädiktor für einen frühen Progress der Hautsklerose bei SSc zu sein (HR 3,45; p=0,007). (21)
Rituximab bei SSc
In einer kleinen Kohorte von 14 SSc-Patienten mit einer myokardialen Beteiligung wurde unter dem kombinierten Einsatz von Rituximab (RTX) und MMF ein Rückgang von Troponin T bei allen Patienten (p=0,0002), eine Verbesserung der LVEF bei 5/14 (Verschlechterung bei 2/14), ein Rückgang von ventrikulären Extrasystolen bei 8/14 Patienten, eine Verbesserung des systolischen PA-Drucks bei allen mit pulmonaler arterieller Hypertonie und eine Verbesserung der FVC bei 7/14 (Verschlechterung bei 1/14) verzeichnet. Die Hautsklerose (mRSS) verbesserte sich bei allen Patienten. (22) In einer kleinen rumänischen Beobachtungskohorte von 10 schwer betroffenen SSc-Patientinnen (mittlerer mRSS >19) zeigte sich unter RTX ein signifikanter Rückgang des mRSS. (23) Auch wenn es sich um kleine, offene und unkontrollierte Studien handelt, sind die Effekte bemerkenswert, zumal wenn man sich den Spontanverlauf der SSc vor Augen hält.
Der Effekt von RTX auf die SSc-ILD wurde in einer größeren spanischen Kohorte von 37 Patienten prospektiv untersucht, welche RTX über durchschnittlich 38 (18-69) Monate erhielten. (24) Die ILD blieb stabil oder verbesserte sich bei 62 % der Patienten, bei 19 % hatte sich die ILD verschlechtert und weitere 19 % sind verstorben. Die Lungenfunktion verschlechterte sich zunächst noch geringfügig zu Beginn der RTX-Behandlung, was dem Spontanverlauf der SSc-ILD und dem bekannt verzögerten Wirkeintritt einer Anti-B-Zelltherapie zuzuschreiben ist; es kam aber dann im weiteren Verlauf nicht mehr zu einer weiteren Verschlechterung. Unabhängige Prädiktoren für eine Verschlechterung der ILD waren in der multivariaten Analyse eine schlechte Ausgangs-DLCO, eine längere Zeit bis zum Einsatz von RTX und der fehlende Einsatz von MMF.
Tocilizumab bei SSc-ILD
In einer ersten Phase-II-Studie (faSScinate) zum Einsatz von Tocilizumab (TCZ) bei der SSc mit 87 Patienten (25) war der primäre Endpunkt einer Verbesserung der Hautsklerose (mRSS) in Woche 24 numerisch, aber nicht statistisch signifikant besser (p=0,09) mit -3,92 gegenüber -1,22 Punkten in der Placebogruppe. In dem sekundären Endpunkt eines geringeren Anteils von Patienten mit Verschlechterung der FVC unter TCZ war dies aber sehr wohl der Fall (p=0,037).
Leider wurde in der dann folgenden Phase-III-Studie (focuSSced) mit TCZ (162 mg s.c./Woche versus PBO über 48 Wochen) auch die Hautsklerose, gemessen mit dem mRSS, als primärer Endpunkt gewählt und nicht eine Verbesserung einer ILD. (26) Hier wurden 212 Patienten randomisiert und 210 behandelt (106 PBO, 104 TCZ). Eine Verbesserung im mRSS war nach 48 Wochen auch schon in der Placebo-Gruppe mit -4,41 Punkten unerwartet hoch, sodass die Veränderung des mRSS in der TCZ-Gruppe mit -6,14 Punkten statistisch nicht signifikant unterschiedlich war (p=0,098). Somit wurde der primäre Endpunkt auch dieser Studie verfehlt, aber auch hier fand sich wieder ein günstiger Einfluss auf die SSc-ILD. Die FVC war nach 48 Wochen unter TCZ (+Standardtherapie) durchschnittlich nahezu konstant geblieben mit -0,6 %, während sie unter Placebo (+Standardtherapie) um -3,9 % abnahm, was einer mittleren Differenz von 167 ml entsprach. Fünf (5,4 %) Patienten wiesen unter TCZ einen absoluten Rückgang der FVC um ≥10 %-Punkte auf, gegenüber 15 (16,5 %) unter PBO und auch im HRCT zeigte sich unter TCZ eine geringere Progression.
Obwohl diese Studie ihren primären Endpunkt (Verbesserung der Hautsklerose) verfehlte, hat die FDA Tocilizumab aufgrund der vielversprechenden Daten zur Lungenfunktion im März 2021 zur Behandlung der SSc-ILD zugelassen. Auch eine auf dem EULAR vorgestellte Metaanalyse von inzwischen 13 Studien zum Einsatz von TCZ bei SSc ergab für die Haut nur einen marginalen Effekt bei 40 % der Patienten, während sich für die Lunge ein signifikant reduziertes Risiko für eine Verschlechterung der FVC zeigte. (27)
Anti-IL-17-Therapie bei SSc?
Wenig Beachtung fand ein Poster mit sensationellen (!) Ergebnissen einer prospektiven, randomisierten, placebokontrollierten Phase-III-Studie aus Japan zum Einsatz des Interleukin (IL)-17-Rezeptorantikörpers Brodalumab (zugelassen für die Behandlung der Psoriasis und – in einigen Ländern – der Psoriasis-Arthritis) bei der SSc. (28) Dass man bei dem „medical need“ dieser Erkrankung jedes verfügbare Immuntherapeutikum versuchsweise einsetzt, bedarf eigentlich keiner Begründung. Dennoch lieferten die Autoren ein pathophysiologisches Modell für eine potentielle Wirksamkeit einer Anti-IL-17-Therapie („reverse Translation“). Einschlusskriterien waren ein relativ hoher mRSS von 10-29 und eine Krankheitsdauer <60 Monate. 100 Patienten (90 % mit diffus-kutaner SSc) erhielten 1:1 randomisiert über 52 Wochen alle 2 Wochen 210 mg Brodalumab oder Placebo s.c. Der primäre Endpunkt war die Veränderung des mRSS in Woche 24. Patienten mit einem Anstieg des mRSS um ≥5 Punkte oder ≥20 % gegenüber dem Ausgangswert konnten in Woche 24 offen auf Brodalumab wechseln. Dies war bei 38 der Fall, wovon (nach Entblindung) 37 aus der Placebogruppe kamen und nur einer aus der Brodalumab-Gruppe.
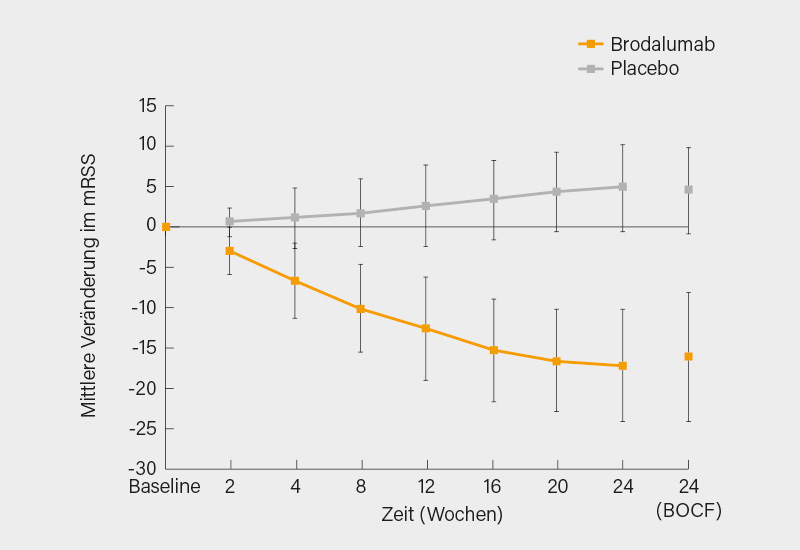
Unter Brodalumab wurde der primäre Endpunkt einer Verbesserung des mRSS mit einem DLSM von -21,2 mit hoher Signifikanz (p<0,0001) erreicht (nota bene, das entspricht nicht 21,2 Punkten im mRSS). Die Verbesserung im mRSS begann schon in Woche 4, nahm bis Woche 24 weiter zu, um dann bis zum Studienende nach 52 Wochen anzuhalten (Abb. 4).
Unter Brodalumab kam es auch zu weniger neuen digitalen Ulzerationen, seltener zu einer Verschlechterung der Lungenfunktion bzw. einem Progress einer ILD und zu einer geringeren Häufigkeit von Symptomen eines gastroösophagealen Refluxes. Auch die globale Gesundheitseinschätzung der Patienten und Ärzte sei unter Brodalumab besser gewesen als unter Placebo.
Die Effekte auf alle untersuchten SSc-Manifestationen, insbesondere auch auf die Haut, sind derart deutlich, rasch eintretend und anhaltend, dass einem unweigerlich der Kommentar „zu schön um wahr zu sein“ einfällt, gerade auch angesichts der bekannten Schwierigkeiten in der Behandlung dieser Kollagenose. Aber es handelte sich um eine prospektive, randomisierte Doppelblindstudie mit 100, von Seiten der Haut relativ schwer betroffenen SSc-Patienten aus Japan, und dass der Wechsel in eine offene Behandlung bei Verschlechterung des Hautbefundes zu Woche 24 nur bei einem Patienten unter Brodalumab, aber bei 37 unter Placebo erfolgte, ist auch ein geradezu eklatantes Ergebnis. Es bleibt noch abzuwarten, ob sich hieraus wirklich eine Therapieoption der SSc ergibt, aber bei dem Krankheitsbild dürfte es nicht lange dauern, bis es weitere Berichte oder Studien hierzu gibt.
Prof. Dr. med. Christof Specker
Klinik für Rheumatologie & Klinische Immunologie
Evangelisches Krankenhaus
Pattbergstraße 1-3, 45239 Essen
Literatur: 1 Wallace D et al., Lancet 2018; 392(10143): 222-231 | 2 investor.lilly.com/news-releases/news-release-details/updates-olumiantr-baricitinib-phase-3-lupus-program-and-fda (28. Januar 2022) | 3 Isenberg D et al., Arthritis Rheumatol 2021;73(10): 1835-1846 | 4 Wallace D et al., Arthritis Rheumatol 2020; 72 (Suppl 10): Abstr. 0865 | 5 Li R et al., Ann Rheum Dis 2022; 81 (Suppl 1): 210 (Abstr. LB0005) | 6 Morand E et al., Ann Rheum Dis 2022; 81 (Suppl 1): 209 (Abstr. LB0004) | 7 Rovin BH et al., Lancet 2021; 397(10289): 2070-2080 | 8 Anders HJ et al., Ann Rheum Dis 2022; 81 (Suppl 1): 189 (Abstr. OP0285) | 9 Saxena A et al., Ann Rheum Dis 2022; 81 (Suppl 1): 325 (Abstr. POS0186) | 10 Mougiakakos D et al., N Engl J Med 2021; 385(6): 567-569 | 11 Schett G et al., Ann Rheum Dis 2022; 81 (Suppl 1): 185 (Abstr. OP0279) | 12 Shan S et al., Ann Rheum Dis 2022; 81 (Suppl 1): 1451 (Abstr. AB0649) | 13 Pedretti E et al., Ann Rheum Dis 2022; 81 (Suppl 1): 1480 (Abstr. AB0708) | 14 Loarce-Martos J et al., Ann Rheum Dis 2022; 81 (Suppl 1): 715 (Abstr. POS0847) | 15 Demirdal D et al., Ann Rheum Dis 2022; 81 (Suppl 1): 751 (Abstr. POS0905) | 16 Tseng CW et al., Ann Rheum Dis 2022; 81 (Suppl 1): 1476 (Abstr. AB0697) | 17 Shirai T et al., Ann Rheum Dis 2022; 81 (Suppl 1): 712 (Abstr. POS0841) | 18 Hoffmann-Vold AM et al., Ann Rheum Dis 2022; 81 (Suppl 1): 720 (Abstr. POS0854) | 19 Sarbu AC et al., Ann Rheum Dis 2022; 81 (Suppl 1): 731 (Abstr. POS0873) | 20 Volkmann E et al., Ann Rheum Dis 2022; 81 (Suppl 1): 723 (Abstr. POS0859) | 21 Schumacher L et al., Ann Rheum Dis 2022; 81 (Suppl 1): 730 (Abstr. POS0872) | 22 Adjailia EB et al., Ann Rheum Dis 2022; 81 (Suppl 1): 1458 (Abstr. AB0660) | 23 Cristina N et al., Ann Rheum Dis 2022; 81 (Suppl 1): 1474 (Abstr. AB0693) | 24 Mena-Vázquez N et al., Ann Rheum Dis 2022; 81 (Suppl 1): 739 (Abstr. POS0886) | 25 Khanna D et al., Lancet. 2016; 387(10038): 2630-2640. Erratum in: Lancet 2018; 391(10128): 1356 | 26 Khanna D et al., Lancet Respir Med 2020; 8(10): 963-974. Erratum in: Lancet Respir Med 2020; 8(10): e75. Erratum in: Lancet Respir Med 2021; 9(3): e29 | 27 Dos Santos R et al., Ann Rheum Dis 2022; 81 (Suppl 1): 101 (Abstr. OP0156) | 28Fukasawa T et al., Ann Rheum Dis 2022; 81 (Suppl 1): 736 (Abstr. POS0881)