Gehäuftes Vorkommen einer Myasthenia gravis bei SLE?
SLE und Myasthenia gravis (MG) sind relativ seltene Autoimmunerkrankungen, sodass ihr gemeinsames Vorkommen rein statistisch eine extreme Rarität darstellen müsste. Dem widerspricht aber die klinische Erfahrung: Man trifft immer wieder auf Lupus-Patientinnen, welche in ihrer Vorgeschichte eine MG (vor allem bei Thymom) gehabt haben. Die MG betrifft wie der SLE überwiegend junge Frauen, verläuft meist schubförmig und antinukleäre Antikörper (ANA) sind bei der MG auch häufiger zu finden. Es gab bislang keine kontrollierte epidemiologische Studie über einen eventuellen Zusammenhang dieser beiden Krankheitsbilder. Aus der IBM Explorys-Versicherungsdatenbank von mehr als 60 Millionen anonymisierten US-Patienten erfolgte nun eine retrospektive Auswertung aggregierter, standardisierter, normalisierter klinischer Daten aus verschiedenen elektronischen Gesundheitsakten, die automatisch und nahezu in Echtzeit aktualisiert werden. Die Definition von SLE- und MG-Patienten erfolgte nach ICD-Verschlüsselung: für SLE mindestens 2 Visiten beim Rheumatologen mit der Diagnose SLE (ICD M32.#). Die Prävalenzraten unter den 59.896.040 aktiven Patienten dieser Datenbank lagen für SLE bei 0,1 % und für MG bei 0,04 %, was statistisch eine Prävalenz des gleichzeitigen Vorkommens von 4 auf 100.000 (0,004 %) ergeben würde. Von 26.110 MG-Patienten hatten aber 370 (1,42 %) die Diagnose SLE im Vergleich zu 65.000 der 59.869.730 Kontrollen
(0,11 %). Die Odds Ratio (OR) lag somit bei 13,4 (p<0,0001) für das gleichzeitige Auftreten von MG und SLE. (1)
Weibliches Geschlecht, afroamerikanische Rasse, ein Zustand nach Thymektomie, das Vorhandensein anderer Autoimmunerkrankungen (u. a. der Schilddrüse) waren bei MG-Patienten, die einen SLE entwickelten, deutlich häufiger als bei denen ohne SLE. Die Autoren empfehlen daher, dass MG-Patienten auf einen gleichzeitig bestehenden SLE hin untersucht werden sollten, insbesondere nach Thymektomie. (1) Umgekehrt sollten SLE-Patienten mit unerklärlicher Muskelschwäche auf MG untersucht werden. Vielleicht ist auch die vielberichtete Fatigue-Symptomatik bei SLE manchmal Ausdruck einer (subakuten) Myasthenie? Dies kann man durch die Bestimmung von Acetylcholin-Rezeptor-Antikörpern prüfen. Diese sollten bei positivem Befund Anlass geben, die Diagnose einer Myasthenie beim Neurologen überprüfen zu lassen.
Kardiotoxizität von HCQ?
Immer wieder werden die sehr seltene Induktion von Myopathien (CK-Erhöhung) und eine Kardiotoxizität von Hydroxychloroquin (HCQ) diskutiert. Dies beruht u. a. auf Daten, die sich noch auf Chloroquin und vor allem auf höhere Dosierungen der Antimalariamittel bezogen. Einzelne „ausgesuchte“ Fälle von SLE-Patienten mit kardialen Nebenwirkungen wurden dann vor einigen Jahren in der großen Toronto-Kohorte analysiert und auf den Tagungen diskutiert. (2) Dabei konnte man zu dem Schluss kommen, dass die dort berichteten kardialen Effekte doch recht deutlich überbewertet wurden. Zu dieser Schlussfolgerung gelangte auch eine US-amerikanische Arbeitsgruppe, welche EKGs von 681 Patienten zur Frage eines Long-QT-Syndroms auf dem ACR 2020 vorgestellt hatte. (3) In 2021 konnte eine weitere prospektive Studie aus den USA, welche das Auftreten einer QTc-Verlängerung im EKG im Zusammenhang mit Plasmaspiegelbestimmungen von HCQ bei 84 SLE-Patienten (93 % weiblich) untersuchte, auch keine Korrelation zwischen HCQ-Blutspiegeln und QTc-Intervallen, auch nicht bei Vergleich von 200 oder 400 mg HCQ/Tag oder bei Patienten mit Niereninsuffizienz (eGFR <60 ml/min.), finden. (4) Nur die gleichzeitige Einnahme QTc-verlängernder Medikamente (z. B. Ciprofloxazin, Levofloxazin, Doxepin, Risperidon, Salbutamol, Duloxetin, Citalopram, Metoclopramid) führte zu einer statistisch signifikanten Verlängerung (r=0,795; p=0,005), die jedoch nie über die kritische Grenze von 456 msec. hinausging.
Eine monozentrische Kohorte von 1.095 SLE-Patienten mit 10.370 Visiten, bei denen seit 2013 HCQ-Vollblutspiegel vierteljährlich bestimmt wurden, belegte wieder die günstigen Effekte von HCQ. Es bestand eine Assoziation höherer HCQ-Blutspiegel mit niedrigeren Aktivitätsscores (SLEDAI), mit einer geringeren Eiweißausscheidung im Urin (UPCR) und niedrigeren systolischen Blutdruckwerten. Auch intraindividuell führten höhere HCQ-Blutspiegel zu einer Verbesserung der UPCR und Senkung des Blutdrucks. Die HCQ-Blutkonzentration korrelierte in dieser Untersuchung aber nicht signifikant mit Veränderungen der Haut- oder Gelenkmanifestationen des SLE. (5)
Infektionsrisiko bei SLE-Patienten unter Rituximab
Zur Frage des Infektionsrisikos unter einer Therapie mit Rituximab (RTX) bei SLE wurde eine britische Studie vorgestellt, in der aus einem großen nationalen Biologika-Register innerhalb des ersten Jahres nach einer Anti-B-Zelltherapie mit RTX schwerwiegende Infektionen, antibiotische i.v.-Therapien, Hospitalisierungen, dauernder Schaden oder Tod erfasst wurden. Es wurden 764 SLE-Patienten unter Rituximab mit 167 Kontrollen verglichen, die nur Standard-Immunsuppressiva (SoC) erhielten. (6) Diese bestanden aus Mycophenolat Mofetil (MMF) (n=126, 75 %), Azathioprin (n=46, 28 %) und/oder Cyclophosphamid (n=38, 23 %). Die Ausgangscharakteristika beider Gruppen waren ähnlich, RTX-Patienten wiesen aber eine längere Krankheitsdauer (4,2 vs. 1,8 Jahre) auf, hatten schon mehr Immunsuppressiva im Vorfeld, öfter eine COPD (14 vs. 7 %), eine niedrigere Glukokortikoid (GK)-Erhaltungsdosis sowie etwas niedrigere IgG-Spiegel (12 vs. 15 g/l). Im ersten Jahr nach Beginn einer RTX- oder SoC-Therapie war es zu 259 Infektionen bei 143 Patienten (15 %) gekommen, darunter 106 (41 %) schwere Infektionen. In der RTX-Gruppe betraf dies 127 Patienten (17 %), in der SoC-Gruppe 16 (10 %; p=0,022). Es gab keinen signifikanten Unterschied bei schweren Infektionen mit 8 % (RTX) bzw. 6 % (SoC). Nach Adjustierung auf Alter und Geschlecht waren in der RTX-Gruppe folgende Faktoren mit einem erhöhten Infektionsrisiko verbunden: Anzahl von Komorbiditäten (OR 1,34), Dauersteroiddosis (OR 1,05) und IgG <6,0 g/l (OR 2,35). Die häufigsten schweren Infektionen betrafen Atemwege (n=24, 23 %), Knochen/Weichteile (n=14, 13 %), HNO-Gebiet (n=11, 10 %) und Urogenitaltrakt (n=8, 8 %). Ein RTX-Patient starb innerhalb eines Jahres nach Behandlungsbeginn an einer Sepsis.
Die Autoren kamen zu dem Schluss, dass mit Rituximab behandelte SLE-Patienten kein erhöhtes Risiko für schwere Infektionen im Vergleich zu Patienten unter einer Standard-Immunsuppression aufweisen. Die dauerhafte Einnahme von GK, eine Hypogammaglobulinämie und Komorbiditäten erhöhen das Infektionsrisiko aber signifikant. Hier wird wieder deutlich, dass man die Risiken nicht einfach auftrennen kann. RTX allein scheint das Risiko nicht (bzw. nur für leichte Infektionen) zu erhöhen, wenn weitere Risikofaktoren hinzukommen, die zum Teil gerade bei den RTX-Patienten vorhanden sind, ist das Risiko dann doch erhöht. Einzelne dieser zusätzlichen Risikofaktoren (wie Steroiddosis, Hypogammaglobulinämie) kann man beeinflussen und dies sollte man im Auge behalten.
Neue Therapien für den SLE: Voclosporin und Anifrolumab
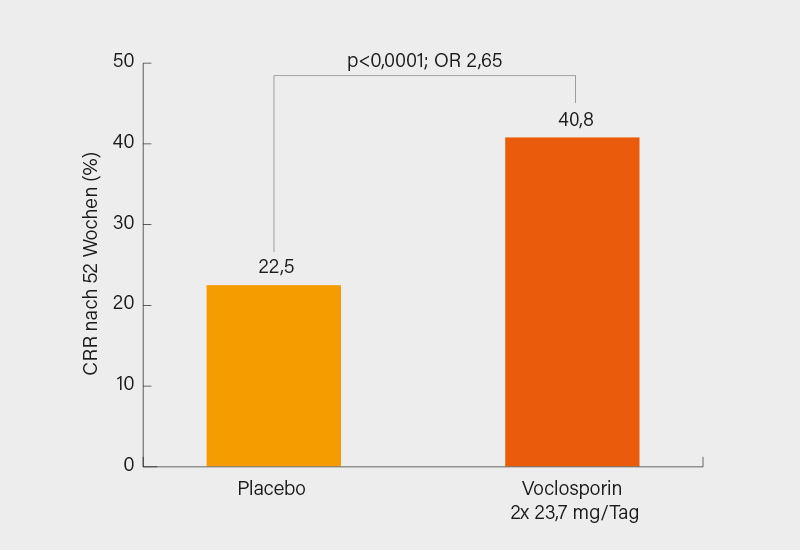
Über den neuen Calcineurininhibitor Voclosporin (VCS) wurde an dieser Stelle schon vom diesjährigen EULAR berichtet. Die FDA wartet inzwischen mit Zulassungen nicht immer bis zulassungsrelevante Studien veröffentlicht wurden. VCS wurde in den USA bereits im Januar 2021 in Kombination mit MMF zur Behandlung der Lupusnephritis (LN) zugelassen und erst im Mai 2021 wurde die AURORA Studie publiziert. (7) Der primäre Endpunkt einer renalen Response zu Woche 52 wurde unter (zusätzlicher) Gabe von VCS (n=179) mit 40,8 % deutlich häufiger erreicht als unter alleiniger Gabe von MMF (n=178) mit 22,5 % (OR 2,65; p<0,001) (Abb. 1). Nachdem auf dem EULAR 2021 die 12-Monatsdaten der 2-jährigen, weiter verblindeten und kontrollierten Verlängerungsstudie (AURORA-2) vorgestellt wurden (8), betrug die Beobachtungsdauer bei der jetzt auf dem ACR präsentierten nächsten Analyse 30 Monate (12 Monate in AURORA-1, 18 Monate in AURORA-2). (9) Dies ist insofern von Bedeutung, als die Nachbeobachtung der meisten (sämtlicher?) LN-Studien bislang nie über 2 Jahre hinausging und auch nicht mehr im kontrollierten und verblindeten Design erfolgte. Den dauerhaften Erfolg einer Behandlung der Lupusnephritis (z. B. im Hinblick auf die Verhinderung einer terminalen Niereninsuffizienz) kann man aber oft erst nach 3-5 Jahren ermessen.
In der AURORA-2-Studie wurde also die randomisierte Behandlung mit Voclosporin (2x 23,7 mg/Tag) oder Placebo in Kombination mit MMF (2x 1 g/Tag) und niedrig dosierten Steroiden fortgeführt. Primäre Endpunkte waren die renale Eiweißausscheidung, bestimmt mit der UPCR und geschätzten glomerulären Filtrationsrate (eGFR).
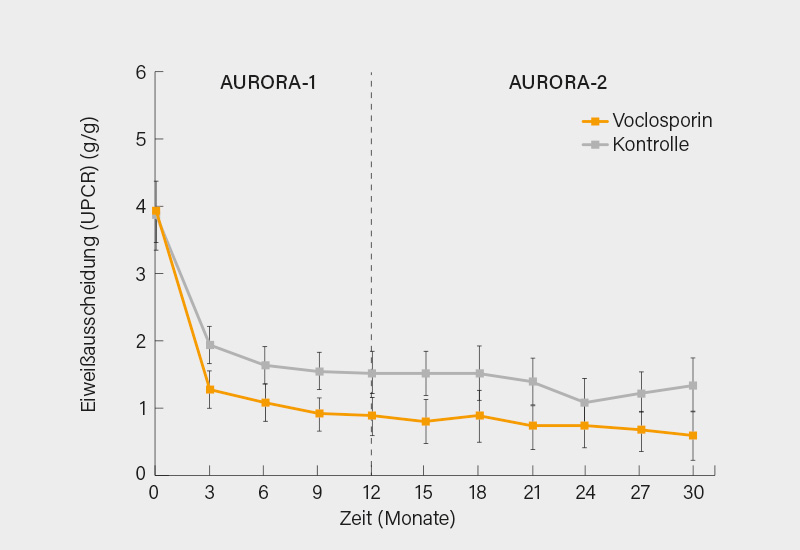
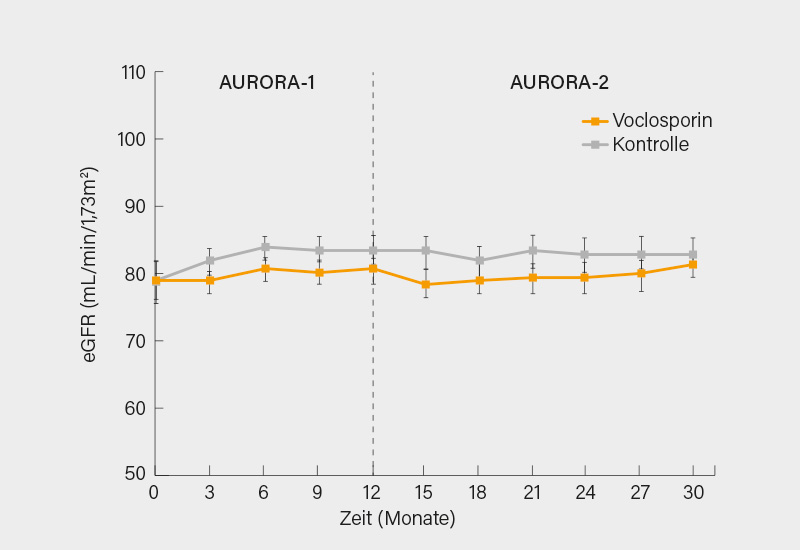
Von den 179 Patienten, die in AURORA-1 mit VCS behandelt wurden, nahmen 116 (65 %) an der Extensionsstudie teil. Die UPCR betrug zu Beginn der Therapie mit VCS (AURORA-1) bei den 116 Patienten, die unter VCS in die Extensionsphase wechselten 3,94 und 3,87 bei den 100 Patienten des Kontrollarms. Die unter VCS gegenüber der alleinigen Therapie mit MMF geringere UPCR in den ersten 12 Monaten setzte sich unter fortgeführter Therapie mit VCS auch über 30 Monate hinweg fort (Abb. 2). In den ersten vier Wochen der VCS-Behandlung (AURORA-1) kam es zu einem geringen Abfall der mittleren eGFR, danach blieb die eGFR aber über 30 Monate stabil (Abb. 3). Es wurden unter VCS keine unerwarteten neuen unerwünschten Ereignisse (UE) im Vergleich zu den Kontrollen beobachtet.
Das Therapieprinzip einer Kombination von MMF mit einem Calcineurininhibitor ist nicht neu. Tacrolimus wurde in Kombination mit MMF als „multitargeted therapy“ der Lupusnephritis sowohl in der Induktions- (10) als auch in der Erhaltungstherapie (11) schon recht intensiv und mit Erfolg geprüft, bislang aber fast ausschließlich bei asiatischen Patienten, und eine Zulassung von Tacrolimus ist nicht in Sicht. Dies dürfte angesichts der deutlichen Effekte einer zusätzlichen Therapie mit Voclosporin in dieser Phase-III-Studie anders sein. Eine Zulassung ist für 2022 auch in der EU zu erwarten.
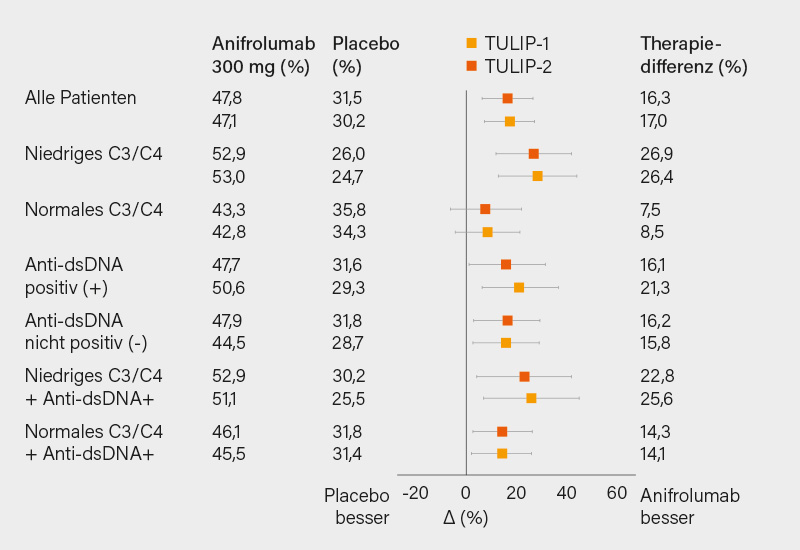
Zu dem Interferon (IFN)-α-Rezeptor-Antikörper Anifrolumab (ANIFR) und die beiden großen Phase-III-Studien TULIP-1 (12) und TULIP-2 (13) wurde an dieser Stelle schon öfter berichtet. Auch diese neue Substanz wurde in den USA bereits im August 2021 zugelassen und dürfte bei uns auch in 2022 zur Verfügung stehen. Auf dem EULAR-Kongress 2021 wurde eine Metaanalyse aller 3 Studien mit insgesamt 839 Patienten, davon 372 unter ANIFR, vorgestellt (14), bei der die Domänen Hautbeteiligung (CLASI-Score), GK-Reduktion und beide Aktivitätsindices (SRI und BICLA-Response) unter ANIFR signifikant besser waren als unter Placebo (SRI-4 allerdings nicht in der TULIP-1). Auch das für Anti-IFNα-Therapien bekannte Risiko von Zoster-Infektionen kam dabei zum Ausdruck. Sonstige schwere UEs waren unter ANFR eher seltener als unter Placebo. Inwieweit sich das Ansprechen auf eine Anti-IFN-α-Therapie anhand serologischer Untergruppen unterscheidet, was dann eine bessere Charakterisierung hierfür in Frage kommender SLE-Patienten erlauben würde, sollte eine neue Post-hoc-Analyse der beiden TULIP-Studien zeigen. (15) Dabei ergab sich nur für Patienten, welche eine Komplementverminderung zu Beginn der Studie aufweisen ein besseres Ansprechen als bei denjenigen mit normalen Komplementspiegeln (Abb. 4). Dies war für dsDNA-Antikörper nicht der Fall. Letztendlich überlappen sich aber die serologischen Subgruppen derart, dass man daraus wohl noch keine klaren Schlüsse ableiten kann. Der genaue Stellenwert dieser neuen Therapieoption wird sich erst im klinischen Alltag herauskristallisieren, wie dies auch schon bei Belimumab der Fall war.
Baricitinib als potenzielle neue Therapieoption bei SLE?
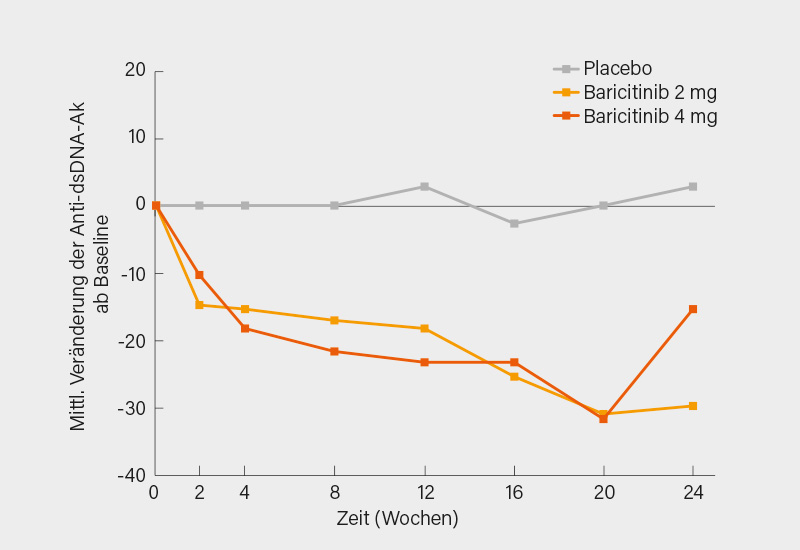
Über eine Phase-II-Studie zum Einsatz von Baricitinib bei SLE (16) wurde erstmals auf dem ACR-Meeting 2018 berichtet. Zwei Phase-III-Studien hierzu sind zwar bereits abgeschlossen (November 2021), die Ergebnisse sind aber noch nicht verfügbar. Mehrfach (auch an dieser Stelle) wurde bei der Phase-II-Studie kritisch angemerkt, dass in dieser keine Analyse der Wirkung von Baricitinib auf serologische SLE-Aktivitätsparameter erfolgt war. Dies wurde nun auf dem ACR nachgeliefert und von Thomas Dörner, Berlin, und Kollegen vorgestellt. (17) Bei Patienten mit positiven Anti-dsDNA-Antikörpern (Anti-dsDNA) zu Beginn der Studie, was bei ca. 50 % aller Studienpatienten der Fall war, fand sich ein signifikanter Rückgang der Anti-dsDNA unter Baricitinib im Vergleich zu Placebo (Abb. 5). Ähnlich sah dies für die Serum-IgG-Spiegel aus, es konnten aber keine entsprechenden Veränderungen für die Komplementfaktoren C3 und C4 gefunden werden.
Rituximab bei der systemischen Sklerose?
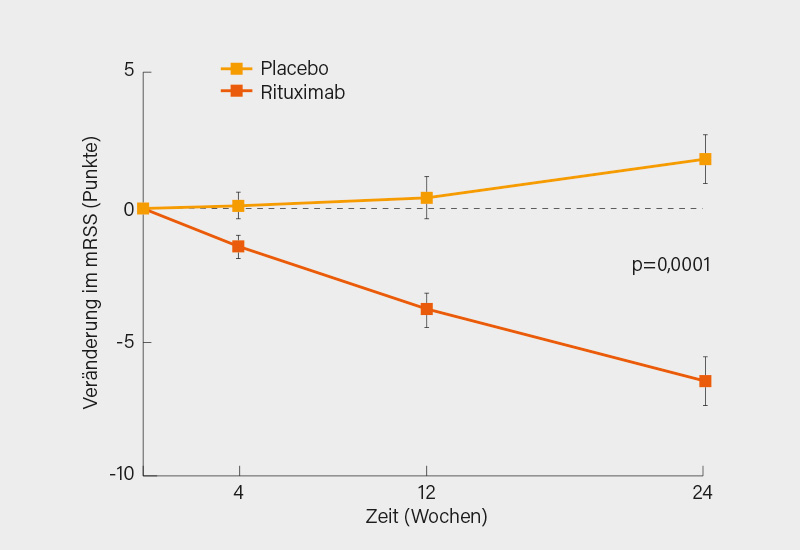
Auch wenn es nicht den Lupus betrifft, soll an dieser Stelle über eine wichtige Studie vom letzten ACR-Meeting berichtet werden, nämlich zum Einsatz von Rituximab bei der systemischen Sklerose (SSc), wozu es bislang nur Fallserien und Analysen aus Registern (z. B. EUSTAR) gab. In Japan wurden 54 SSc-Patienten doppelblind randomisiert mit RTX (4x 375 mg/m²) behandelt oder mit Placebo. (18) Primärer Endpunkt war die Hautsklerose, gemessen mit dem Rodnan-Skin-Score (mRSS), ein sekundärer Endpunkt war die Lungenfunktion bzw. die FVC(%predicted). Der durchschnittliche mRSS verbesserte sich nach 24 Wochen um 6,3 Punkte in der RTX-Gruppe während er sich in der Placebo-Gruppe um mehr als 2,1 Punkte verschlechterte (p<0,001) (Abb. 6). Auch wenn der mRSS sicher größeren Inter-Observer-Schwankungen unterliegt, kann man dieses Ergebnis aufgrund des prospektiven, randomisierten und verblindeten Designs der Studie schon ernst nehmen. Auch die prozentuale Veränderung der FVC blieb in der RTX-Gruppe konstant (+0,09 %), während sie sich, wie bei der SSc leider meist, in der Placebo-Gruppe um 2,87 %-Punkte verschlechterte. Zusätzliche Sicherheitssignale wurden unter RTX nicht verzeichnet.
Diese Studie (DESIRES) wurde auch schon als Full-paper in Lancet Rheumatology veröffentlicht (19) und führte in Japan zur Zulassung von Rituximab bei der SSc. Auch wenn hierdurch nicht unbedingt eine Zulassung in Europa zu erwarten ist, könnte diese Studie eine wertvolle Argumentationshilfe bieten bei eventuellen Kostenübernahmeanträgen beim Medizinischen Dienst der Krankenkassen.
COVID-19: Impfungen bei SLE
Es liegt auf der Hand, dass aktuell kein wissenschaftlicher Kongress ohne Studien zur Coronapandemie auskommt. Zur Frage, ob COVID-19 bei SLE zu einem Schub führt, konnten in einer Auswertung der Baltimore-Kohorte unter 860 SLE-Patienten 65 mit einem positiven PCR-Test identifiziert werden. (20) 38 dieser Patienten hatten mindestens eine Untersuchung innerhalb von 6 Monaten vor und nach dem positiven PCR-Test. Im Durchschnitt waren alle Aktivitätsscores (PGA, SLEDAI, LAI) nach COVID-19 niedriger als zuvor und auch dsDNA-Antikörper und Komplement blieben unbeeinflusst. Nur IgG- und IgM-Antikörper gegen Cardiolipin (aCL) waren nach einer COVID-Infektion öfter angestiegen. In dieser Kohorte hatten 228 SLE-Patienten eine COVID-19-Impfung erhalten (10x Johnson & Johnson; 94x Moderna; 124x BioNTech/Pfizer; 13 Patienten hatten vor der Impfung schon COVID-19 durchgemacht). 98 SLE-Patienten hatten mindestens einen Visit innerhalb von 6 Monaten vor der Impfung und mindestens einen Visit nach der Impfung. Auch bei diesen zeigte sich nach der Impfung ein (leichter) Rückgang der Krankheitsaktivität, Antiphospholipid- und dsDNA-Antikörper sowie Komplement blieben unbeeinflusst.
Zur Frage der Verträglichkeit der Impfungen erfolgte auch eine Patientenbefragung, bei der 12 von 136 SLE-Patienten (8,8 %) über einen „Schub“ innerhalb von 2 Wochen nach der Impfung berichteten. (21) Die meisten Schübe wurden aber schon von den Patienten selbst als „mild“ eingestuft (78 % nach 1., 60 % nach 2. Impfung) und diese bestanden zu 85 % auch nur aus Gelenk- bzw. Muskelschmerzen und Müdigkeit. Kein Schub trat später als 7 Tage nach der Impfung auf und die meisten Schübe klangen innerhalb einer Woche spontan wieder ab. Nur in 2 Fällen wurden deswegen GK eingenommen. Insgesamt haben mehr als 91 % der Patienten die Impfung nach eigenen Angaben gut vertragen. Eine weitere internationale Umfrage unter 696 Lupus-Patienten ergab zwar Nebenwirkungen von 45 % nach 1. und 53 % nach 2. Impfung, diese waren aber wieder zu 90 % Muskel- und Gelenkbeschwerden oder Müdigkeit, verliefen ohne Beeinträchtigung der „Alltagstätigkeit“, hatten in weniger als 8 % eine Arztkonsultation zur Folge und führten nur in 0,5 % aller 1.039 Impfungen zu einer Hospitalisierung. (22) Abgesehen davon, dass sich die „Schübe“ kaum von Impfreaktionen bei Gesunden unterschieden sind dies sicher insgesamt sehr „beruhigende“ Daten.
Auch die Impfantwort nach COVID-19-Impfung wurde bei SLE-Patienten untersucht. Die IgG-Seroreaktivität wurde anhand der Antikörper gegen die SARS-CoV-2-Spike-Rezeptor-Bindungsdomäne im EIA und mittels SARS-CoV-2-Neutralisationstest untersucht und zellulär die antigenspezifische IFN-γ-Produktion mittels ELISpot bei 90 SLE-Patienten und 20 gesunden Kontrollpersonen, die vollständig gegen COVID-19 geimpft worden waren. (23) 26 Patienten (29 %) zeigten eine IgG-Antikörperreaktion unterhalb der niedrigsten Spiegel der Kontrollen. Die Korrelationen der SARS-CoV-2-Spike-RBD-IgG-Antikörper mi dem Mikroneutralisationstest war sehr gut (r=0,81; p<0,0001), mit dem ELISpot (T-Zell-Antwort) nur moderat (r=0,57; p<0,0135). Signifikante Risikofaktoren für eine schlechte Impfantwort waren Prednison alleine und in Kombination mit mindestens einem Immunsuppressivum (p=0,049), die Kombination von zwei Immunsuppressiva (p=0,01), Prednison alleine (p=0,021) und MMF (p=0,001). Leider war keine Analyse nach der Dosis der jeweiligen Medikamente möglich. Die Impfantwort war übrigens besser unter den mRNA-Impfstoffen gegenüber jenem von Johnson & Johnson (p=0,04). Prädiktoren für eine gute Impfantwort war keine Medikation außer der Einnahme von Antimalariamitteln (OR 11,8; p=0,0006) sowie erhöhte Anti-dsDNA-Antikörper vor der Impfung (OR 7,8; p=0,0047). Schübe nach dem SLEDAI Flare Index wurden zwar in 11,4 % der Fälle gefunden, meist nach der 2. Impfung, schwere Schübe (rezidivierende Arthritis, die Anlass zur Therapieeinleitung von Methotrexat gab) aber nur bei einem der 90 Patienten.
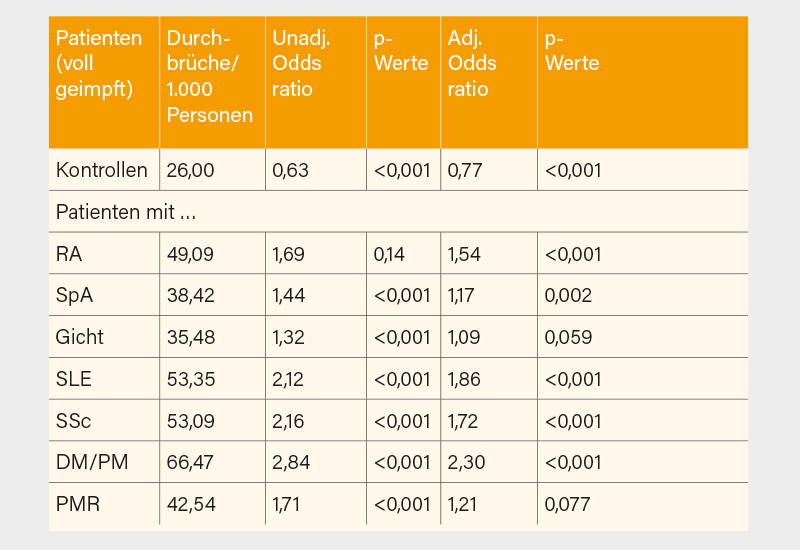
Als Late-breaking Abstract wurde eine Untersuchung zu Durchbruchinfektionen bei entzündlich-rheumatischen Erkrankungen (ERE) vorgestellt. (24) Aus einem US-COVID-19 Register wurden 47.303 Patienten mit ERE (Durchschnittsalter 66 Jahre) mit 536.954 Kontrollen (Durchschnittsalter 50 Jahre) verglichen. Während die Rate an Durchbruchinfektionen bei Vorliegen einer Rheumaerkrankung mit 3,3 bis 4,7 % immer ca. doppelt so hoch war, wie bei denen ohne ERE und auch hier wieder ein etwas schlechterer Impfschutz unter der Vakzine von Johnson & Johnson zu verzeichnen war, wiesen Patienten mit Kollagenosen mit ORs von 1,7 bis 2,3 etwas höhere Raten auf als Patienten mit Spondyloarthritiden oder Polymyalgia rheumatica. Die rheumatoide Arthritis lag mit einer OR von 1,54 dazwischen (Tab. 1).
Prof. Dr. med. Christof Specker
Klinik für Rheumatologie & Klinische Immunologie
Evangelisches Krankenhaus
Pattbergstraße 1-3, 45239 Essen
Literatur: 1 Merjaneh S et al., Arthritis Rheumatol 2021; 73 (Suppl 10): Abstr. 0334 | 2 Tselios K et al., J Rheumatol 2019; 46(4): 391-396 | 3 Park E et al., Arthritis Rheumatol 2020; 72 (Suppl 10): Abstr. 0431 | 4 Haj-Ali M & Belmont HM. Arthritis Rheumatol 2021; 73 (Suppl 10): Abstr. 1743 | 5 Magder L et al., Arthritis Rheumatol 2021; 73 (Suppl 10): Abstr. 1753 | 6 Rodziewicz M et al., Arthritis Rheumatol 2021; 73 (Suppl 10): Abstr. 1288 | 7 Rovin BH et al., Lancet 2021; 397(10289): 2070-2080 | 8 Saxena A et al., Ann Rheum Dis 2021; 80 (Suppl 1): 585 (POS0681) | 9 Saxena A et al., Arthritis Rheumatol 2021; 73 (Suppl 10): Abstr. 1425 | 10 Liu Z et al., Ann Intern Med 2015; 162(1): 18-26 | 11 Zhang H et al., J Am Soc Nephrol. 2017; 28(12):3671-3678 | 12 Furie R et al., Lancet Rheumatol 2019; 1(4): e208-e219 | 13 Morand EF et al., N Engl J Med 2020; 382(3): 211-221 | 14 Razzack AA et al., Ann Rheum Dis 2021; 80 (Suppl 1): 600 (POS0701) | 15 Bruce I et al., Arthritis Rheumatol 2021; 73 (Suppl 10): Abstr. 1742 | 16 Wallace DJ et al., Lancet 2018; 392(10143): 222-231 | 17 Dörner T et al., Arthritis Rheumatol 2021; 73 (Suppl 10): Abstr. 1746 | 18 Ebata S et al., Arthritis Rheumatol 2021; 73 (Suppl 10): Abstr. 0496 | 19 Ebata S et al., Lancet Rheumatol 2021; 3(7): e489-e497 | 20 Petri M et al., Arthritis Rheumatol 2021; 73 (Suppl 10): Abstr. 0858 | 21 Barbhaiya M et al., Arthritis Rheumatol 2021; 73 (Suppl 10): Abstr. 0896 | 22 Felten R et al., Arthritis Rheumatol 2021; 73 (Suppl 10): Abstr. 1421 | 23 Izmirly P et al., Arthritis Rheumatol 2021; 73 (Suppl 10): Abstr. 1420 | 24 Singh J et al., ACR Convergence 2021; Late-breaking Abstr. L16