Hydroxychloroquin
Hydroxychloroquin (HCQ) hat vielfältige günstige Effekte beim SLE. An unerwünschten Wirkungen sind vor allem Visusstörungen durch Netzhautveränderungen bekannt, obwohl diese – insbesondere bei richtiger Dosierung (bezogen auf das Körpergewicht) - extrem selten sind. Noch viel seltener ist die Induktion von Myopathien (CK-Erhöhung) und sind Auswirkungen auf das kardiale Reizleitungssystem (Long-QT-Syndrom).
Wie häufig kommt es unter HCQ zu einem Long-QT-Syndrom?
Zur Frage, wie häufig eine QTc-Verlängerung unter HCQ zu sehen ist, hat eine Arbeitsgruppe aus New York die EKGs von insgesamt 681 Patienten, darunter auch solche mit rheumatoider Arthritis (RA), analysiert. (1) Diese stammten aus zwei prospektiven RA-Kohorten (n=307) und aus einer retrospektiven SLE-Kohorte (n=374). 54 % der Gesamtkohorte (SLE und RA) nahmen HCQ ein, 44 % hatten einen QTc über 440 ms (QTc-Länge 437 ±28 ms). Die QTc-Länge war bei HCQ-Anwendern mit der von Nicht-HCQ-Anwendern vergleichbar und es fanden sich auch keine Unterschiede zwischen RA und SLE. Neun von 11 SLE-Patienten mit einer QTc über 500 ms nahmen HCQ ein, zwei nicht (n. s.). Es fanden sich auch keine Assoziationen von QTc-Verlängerung mit Herzrhythmusstörungen, Todesfällen oder in der Kombination von HCQ mit anderen QTc-verlängernden Medikamenten.
HCQ zur Vermeidung von Damage
Zur Frage der Korrelation von HCQ mit der (Vermeidung) eines chronischen Krankheitsschadens („Damage“) wurden die kumulativen HCQ-Dosen in einer prospektiven SLE-Inzeptionskohorte von 244 SLE-Patientinnen (99 % weiblich; im Mittel 40,7 Jahre; Verlaufsbeobachtung mindestens 10 Jahre) mit dem SLICC/ACR Damage Index (SDI) verglichen. (2) Hierbei fand sich eine signifikante, negative Korrelation zwischen durchschnittlicher jährlicher HCQ-Dosis und dem SDI, d. h. je höher die Dosis war, umso geringer war der kumulative Krankheitsschaden und Patienten ohne kardiovaskuläre Erkrankung (CVE) wiesen eine signifikant höhere durchschnittliche HCQ-Jahresdosis auf als jene 18,8 % der Patienten mit Herzinfarkt, Apoplex oder TIA im Beobachtungszeitraum.
HCQ reduzieren, absetzen oder einfach weitergeben?
Im klinischen Alltag wird man von SLE-Patienten (und Kollegen) oft gefragt, ob man HCQ nicht auch mal wieder absetzen kann, wenn die Erkrankung zur Ruhe gekommen ist. Hierzu hat eine bekannte Arbeitsgruppe aus Toronto die Flare-Rate bei Lupus-Patienten untersucht, die ihre Antimalariamittel (AM) nach Erreichen einer klinischen Remission für mindestens ein Jahr abgesetzt hatten und verglichen deren Verlauf mit Patienten, welche die Therapie fortsetzten. Außerdem untersuchten sie, welchen Unterschied es macht, ob man eine solche Therapie langsam reduziert oder abrupt absetzt. (3)
Die untersuchte Toronto-Kohorte umfasste 1.573 Lupus-Patienten, die jemals mit AM behandelt wurden. 165 Patienten erreichten eine klinische Remission von mindestens einjähriger Dauer und beendeten die Therapie mit AM. Von diesen war bei 96 der anschließende Verlauf über mindestens 2 Jahre verstrichen und von diesen konnten 88 mit passenden (1:2 „gematchten“) Kontrollen von SLE-Patienten verglichen werden, welche ihre AM-Therapie nicht beendet hatten. Neben dem Vorliegen einer Remission waren in der Gruppe, welche die AM-Therapie dann abgesetzt hatten die Gründe hierfür v. a. Patientenwunsch (Wohlbefinden, Schwangerschaft, Bedenken gegen eine Fortführung bei Krankheitsremission) und Hinweise auf bzw. Sorge vor Toxizität (Netzhaut-, mukokutan-, Herzerkrankungen), wobei Hinweise auf Netzhauttoxizität nur bei 1,9 % der Patienten vorlagen. Bei den Patienten, welche die AM abgesetzt hatten, war es in 61,4 % der Fälle zu Schüben (vor allem der Haut und der Gelenke) gekommen, bei denen, welche die Therapie fortgeführt hatten nur in 45,1 % (p=0,002). Über 50 % der Patienten mit AM-Stopp, nahmen diese Therapie, meist wegen eines Krankheitsschubes, wieder auf und bei 88 % dieser Patienten verbesserte sich darunter die Erkrankung wieder bis zur Remission. Von den SLE-Patienten, welche die AM-Therapie beendet hatten, haben 42 % dies schrittweise getan, 58 % hörten „abrupt“ auf. Nach abruptem Absetzen kam es in 73 % der Fälle zu einem Schub, nach schrittweisem Absetzen nur in 46 % (p=0,01). 38 % der Taper-Patienten mussten die Therapie mit AM wieder aufnehmen, 63 % der Stopp-Patienten (p=0,02).
Eine weitere Studie (4) zum Risiko einer Reduktion oder des Absetzens von HCQ unterteilte 1.460 SLE-Patienten der prospektiven SLICC-Inzeptions-Kohorte (Diagnose max. 15 Monate vor Einschluss) in solche mit fortgesetzter AM-Therapie (1.649 Patientenjahre, PJ), solche mit reduzierter AM-Therapie (1.087 PJ) und solche mit abgesetzter AM-Therapie (677 PJ). Eine Remission oder niedrige Krankheitsaktivität war keine Voraussetzung, sodass zum Zeitpunkt der Reduktion oder des Absetzens von HCQ 40 % der Patienten eine gewisse Krankheitsaktivität (SLEDAI >4 Punkte) aufwiesen. Die Ereignisse Schub, neue Immunsuppression oder Hospitalisierung traten in jeweils 100 PJ unter fortgesetzter HCQ-Therapie 32-mal ein und unter reduzierter wie auch abgesetzter HCQ-Therapie 43-mal. Weitere Faktoren für eine schlechte Prognose waren (nicht unerwartet) ein aktiver SLE und die Einnahme von Prednison oder Immunsuppressiva zum Zeitpunkt des Einschlusses in die Inzeptionskohorte (Krankheitsbeginn).
Fazit: In den vorgestellten Studien zum Einsatz von HCQ bei SLE wurden Daten von insgesamt über 3.000 Patienten ausgewertet. Als Fazit kann man folgende Schlüsse ziehen: Kardiale Nebenwirkungen von HCQ sind bei rheumatologischer Dosierung (≤5 mg/kg KG) selten, auch das (gefürchtete) Long-QT-Syndrom. HCQ reduziert das Risiko für Damage, Herzinfarkte und Schlaganfälle. Überdies vermeidet es Schübe, während dessen Absetzen diese provoziert. Wenn man HCQ absetzen möchte, dann langsam und schrittweise.
Anti-B-Zelltherapie
Seit vielen Jahren wird die Anti-B-Zelltherapie beim SLE, zu der man auch Belimumab (Anti-BLyS) rechnen kann, geprüft. Bis auf die Studien mit Belimumab waren alle anderen gegen B-Zellen gerichtete Substanzen (Rituximab, Epratuzumab, Blisibimod, Tabalumab, Ocrelizumab) gescheitert. Dennoch gilt die Anti-B-Zelltherapie mit Rituximab – wenn auch off-label – als die häufigste angewandte Rescue-Therapie beim SLE. (5)
Rituximab und Cyclophosphamid
Über ein intensiviertes Anti-B-Zellprotokoll bei Lupusnephritis berichtete eine italienische Arbeitsgruppe. (6) 30 SLE-Patienten erhielten Rituximab (375mg/m² 4x wöchentlich, dann 2x monatlich) und Cyclophosphamid (CYC; 2x 10 mg/kg KG). An Glukokortikoiden (GK) wurde hochdosiert Methylprednisolon 3 Tage i.v. gegeben und dann oral Prednison, welches innerhalb von 12 Wochen auf 5 mg/Tag reduziert wurde. Danach erfolgte keine (!) weitere immunsuppressive Erhaltungstherapie. Weitere 30 hinsichtlich LN-Klasse und Alter übereinstimmende SLE-Patienten unter Standardtherapie mit Mycophenolat Mofetil (MMF; n=20) oder CYC nach dem Euro-Lupus-Protokoll (n=10) dienten als Kontrollen.
Nach 12 Monaten erreichten mit der intensivierten Anti-B-Zelltherapie eine renale Vollremission 93 % der Patienten, unter MMF 63 % und unter dem Euro-Lupus-Protokoll mit CYC 75 %. Die tägliche Prednisondosis lag bei 2,9 ±5,0 mg (intensivierte Anti-B-Zelltherapie). 10,5 ±8,0 mg (MMF) und bei 7,5 ±9,0 mg für das Euro-Lupus-Protokoll. Im durchschnittlichen Follow-up von 44,5 (36-120) Monaten fanden sich aber zum Schluss keine signifikanten Unterschiede in Bezug auf Proteinurie, Serumkreatinin oder weitere Schübe.
Obinutuzumab
Obinutuzumab ist ein auch gegen CD20 gerichteter Antikörper, der aber gegenüber Rituximab eine wesentlich höhere Rezeptoraffinität aufweist und so zu einer deutlich stärkeren B-Zelldepletion führt. Über dessen Einsatz beim SLE in der Phase-II NOBILITY-Studie wurden beim EULAR die 52-Wochen-Daten berichtet, was auch dem primären Endpunkt entsprach (der nur mit statistischen „Tricks“ formal erreicht wurde). Insofern konnten die nun auf dem ACR vorgestellten 76-Wochen-Daten eigentlich nicht spektakulär sein. (7) Diese erklären aber sehr anschaulich, warum (bis auf eine der BLISS-Studien) alle bisher beim SLE zur Anti-B-Zelltherapie durchgeführten Studien gescheitert sind, welche bereits nach 52 Wochen (oder noch kürzer) einen statistisch signifikanten Effekt nachzuweisen versuchten.
In der NOBILITY-Studie wurde Obinutuzumab bei 125 Patienten mit bioptisch (≤6 Monate) gesicherter, proliferativer LN der Klasse III oder IV und einer entsprechenden Proteinurie (Urin-Protein-Kreatinin-Ratio, UPCR >1) eingesetzt. Das Dosierungsprotokoll entspricht dem von Rituximab bei der RA: Infusionen von 1.000 mg mit Obinutuzumab (oder Placebo) an den Tagen 1, 15 und dann wieder 168 und 182 mit Sicherheits- und Wirksamkeitsanalysen bis Woche 104. Alle Patienten erhielten als Standard-Basistherapie (SoC) MMF und GK mit vorgeschriebener Reduktion.
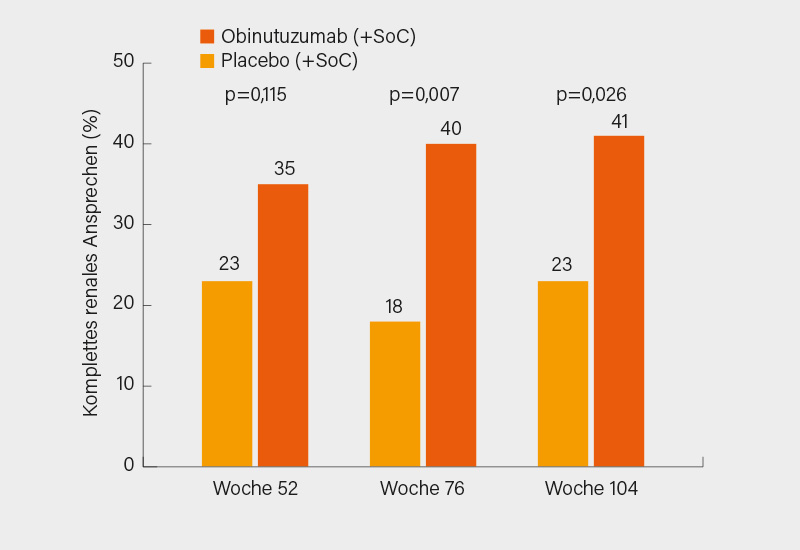
Der primäre Endpunkt war eine komplette renale Remission (CRR) in Woche 52 mit einer (weitgehenden) Normalisierung der Proteinurie (UPCR <0,5), einem normalen bzw. nicht um mehr als 15 % gegenüber dem Ausgangswert angestiegenen Serumkreatinin und ohne Erythrozyturie. Eine CRR in Woche 52 erreichten 34,9 % der Patienten unter Obinutuzumab gegenüber 22,6 % unter Placebo (p=0,115), nach 76 Wochen war der Unterschied aber noch viel größer und statistisch signifikant (Abb. 1), was sich dann auch bis Woche 104 fortsetzte, ohne dass die Therapie noch mal wiederholt worden wäre. Die B-Zellen waren in Woche 52 bei 94 % der Patienten depletiert und zu Woche 104 (80 Wochen nach letzter Gabe von Obinutuzumab) wieder bei 84 % der Patienten restituiert.
LN-Patienten wiesen unter Obinutuzumab auch deutlichere Verbesserungen für eGFR, Proteinurie (UPCR), Anti-dsDNA-Antikörper, C3 und C4 auf. Eine Rescue-Therapie benötigten bis Woche 52 insgesamt sechs (10 %) der Patienten unter Obinutuzumab und acht (13 %) unter Placebo. Auch dieser Unterschied war zu Woche 104 noch deutlicher mit 14 Patienten (22 %) unter Obinutuzumab und 25 Patienten (40 %) unter Placebo. Während schwere unerwünschte Ereignisse bis Woche 104 unter Obinutuzumab mit 25 % und Placebo mit 30 % noch vergleichbar waren, wurden schwere Infektionen unter Obinutuzumab nur in 8 %, unter Placebo in 18 % der Fälle verzeichnet und einem Todesfall unter Obinutuzumab standen vier in der Placebogruppe gegenüber. Nur infusionsbedingte Reaktionen waren unter Obinutuzumab häufiger (15,9 vs. 9,7 %) als unter Placebo.
Fazit: Auch diese Daten zu Obinutuzumab zeigen, dass die Dauer bei Lupus-Studien nicht zu kurz gewählt werden darf. Ganz ähnlich waren die Ergebnisse in den gescheiterten Studien zum Einsatz von Rituximab beim SLE (EXPLORER 2010, LUNAR 2012), welche auch in Woche 52 noch keine signifikanten Unterschiede aufzeigen konnten und dann in der Nachbeobachtung sehr wohl Vorteile der Anti-B-Zelltherapie gegenüber der reinen Standardbehandlung erkennen ließen. Diese Erkenntnisse muss man bei der Konzeption der Studien beachten: Harte Endpunkte (z. B. renale Remission bei aktiver Lupusnephritis) und ausreichend lange Studiendauer (mehr als 52 Wochen) sollten bei den vielen Daten, die es inzwischen zum Einsatz einer Anti-B-Zelltherapie beim SLE gibt, fast ein Garant für ein erfolgreiches Studienergebnis sein. Inzwischen ist die REGENCY-Studie angelaufen, eine Phase-III-Studie zum Einsatz von Obinutuzumab bei Lupusnephritis. Und so liest sich die Definition des primären Endpunktes: Prozentsatz der Patienten mit kompletter renaler Response nach 76 Wochen. Man wird also noch etwas warten müssen, aber diese Studie verspricht, das Armamentarium der Lupus-Therapie zu erweitern.
Belimumab
Weil es zur Zulassung von Belimumab in der Erhaltungstherapie der Lupusnephritis führen dürfte, sei an dieser Stelle nochmal die BLISS-LN Phase-III-Studie vorgestellt, obwohl sie an dieser Stelle schon beim virtuellen EULAR-Kongress (8) abgehandelt wurde. Sie wurde aber (es müssen nicht alle wichtigen Studien zuerst auf dem ACR-Meeting erscheinen) auch noch einmal auf dem ACR vorgestellt (9) und ist inzwischen auch im NEJM erschienen. (10)
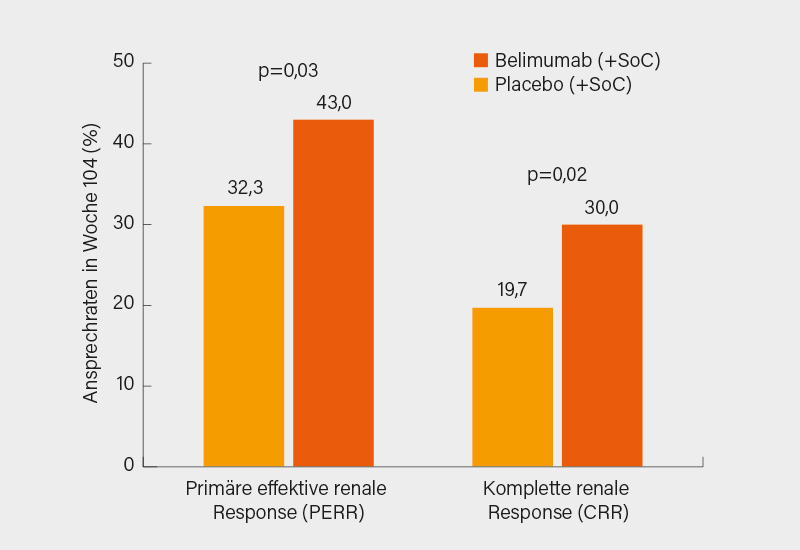
Nach einer (nur) 2-monatigen Induktionstherapie einer proliferativen LN (Klasse III und IV ±V) mit MMF oder i.v. CYC erfolgte die Randomisierung von 448 SLE-Patienten für die zusätzliche Gabe von Belimumab (monatlich 10 mg/kg i.v.) oder Placebo über 24 Monate doppelblind und danach noch mal für 6 Monate als offene Zusatzbehandlung mit Belimumab für alle Patienten, also auch diejenigen, welche vorher Placebo erhielten. Der primäre Endpunkt war der Erhalt der Nierenfunktion mit einer eGFR von mindestens 60 ml/min. bzw. von mindestens 80 % der Ausgangsfunktion und eine Proteinurie (UPCR) von nur noch max. 0,7 nach 24 Monaten (primäre effektive renale Response, PERR). Der sekundäre Endpunkt war eine noch bessere Nierenfunktion und eine noch geringere Proteinurie (komplette renale Response, CRR). Unter Belimumab (+SoC) wurde der primäre Endpunkt mit 43 % der Fälle signifikant häufiger erreicht als unter Placebo (+SoC) mit 32 % (Odds ratio, OR 1,44; KI 95% 1,04-2,32; p=0,03) und auch im sekundären Endpunkt fand sich ein entsprechender signifikanter Vorteil (Abb. 2).
Nach Induktionsbehandlung einer proliferativen LN mit MMF oder i.v. CYC führt die zusätzliche Gabe von Belimumab zur SoC mit Azathioprin oder MMF (24 Monate) zu einem besseren Langzeit-Outcome. Eine Zulassungserweiterung von Belimumab für diese Indikation (Erhaltungstherapie der LN) ist beantragt und dürfte auch erteilt werden. Der Unterschied ist mit 11 % zwar nicht groß, wenn aber Belimumab in dieser Indikation auch für die subkutane Applikation zugelassen wird, wird man im Zweifelsfall bei Patienten, welche eine Remission ihrer Lupusnephritis erreicht haben, zusätzlich Belimumab empfehlen, um diese Option nicht ungenutzt verstreichen zu lassen. Ob dies anhand potenzieller Biomarker (Komplement, Anti-dsDNA-Antikörper?) stratifiziert werden kann oder ob diese als Hinweis für die Dauer dieser Prophylaxe (2 Jahre oder länger?) herangezogen werden können, kann derzeit noch nicht beantwortet werden.
Worüber noch berichtet wurde
In der Phase-Ib-Studie MISSION wurde mit KZR-616 ein erster selektiver „Immunproteasom-Inhibitor“ bei 46 SLE-Patienten geprüft (11) und in einer recht großen Phase-II-Studie mit 288 Patienten Iberdomid, eine oral zu verabreichende Substanz, welche den Abbau von proteasomalen Transkriptionsfaktoren fördert. (12) In der ersten Studie wurden auch Patienten mit aktiver LN eingeschlossen, in der zweiten vorwiegend solche mit Hautmanifestationen. Die Daten waren aber bei beiden Studien zu vorläufig, um hier detailliert erwähnt zu werden.
Mit VIB7734 (Phase-I, 31 Patienten) und mit BIIB059 (Phase-II „LILAC“, 56 Patienten) wurden Antikörper, die gegen dendritische Zellen gerichtet sind und damit auch Typ-1 Interferone (IFN) hemmen, geprüft. (13, 14). Hierbei zeigte sich (wie man dies auch schon von den bisherigen Anti-IFN-Therapien kennt), ein Effekt auf die Haut, wobei die Patienten auch vorwiegend im Hinblick auf Haut- bzw. Haut- oder Gelenkmanifestationen rekrutiert wurden.
Seit ca. 2017 wurde spekuliert, dass Inhibitoren der Bruton’schen Tyrosinkinase (BTK) beim SLE wirksam sein könnten. Während zu Fenebrutinib auf dem ACR und EULAR 2019 noch über „erfolgversprechende“ Ergebnisse berichtet wurde, war hierzu auf dem ACR 2020 nichts mehr zu hören. Aber es wurde eine globale Phase-IIb-Studie mit dem hochselektiven BTK-Inhibitor Evobrutinib bei immerhin 469 SLE-Patienten (1:1:1:1 randomisiert) vorgestellt. Hierbei zeigte sich in keiner Dosierung irgendein Effekt dieses Therapieprinzips, was (endlich mal) auch so von den Autoren kommuniziert wurde. (15)
Wozu nichts berichtet wurde
Manchmal ist es auch von Interesse, wozu es bei dem ACR-Meeting nichts an neuen Informationen gab. Schon lange wird IFN als vielversprechendes Target für eine SLE-Therapie angesehen und vor einem Jahr wurden auf dem ACR die Daten von zwei großen, nahezu identischen und inzwischen auch als Full-Paper veröffentlichten Studien zum Einsatz von Anifrolumab bei SLE, TULIP-1 (16) und TULIP-2 (17) vorgestellt, von denen die erste gescheitert und die zweite erfolgreich war. Man rechnete daraufhin mit einer Zulassung von Anifrolumab, aber diese ist bislang nicht erfolgt und neue Daten zu der Substanz gab es auch nicht.
Auch zur Anti-APRIL-Therapie beim SLE mit Atacicept (18, 19) und zu Telitacicept (20) gab es keine Abstracts beim letzten ACR. Zum Einsatz des Januskinase-Inhibitors Baricitinib (21) und Interleukin-12/23-Inhibitors Ustekinumab (22), wozu seit dem EULAR 2018 regelmäßig berichtet wurde, war auf dem ACR Convergence 2020 ebenfalls nichts mehr zu hören.
Im Falle von Baricitinib dürfte dies daran liegen, dass die Ergebnisse der entscheidenden Phase-III-Studie SLE-BRAVE-X noch nicht vorliegen. Bei Ustekinumab hörte man schon gerüchteweise, dass diese Substanz bei SLE nicht mehr weiterverfolgt würde, nachdem der Hersteller den vorzeitigen Abbruch der Phase-III-Studie LOTUS infolge unzureichender Wirksamkeit vermeldet hatte.
Prof. Dr. med. Christof Specker
Klinik für Rheumatologie & Klinische Immunologie
der Kliniken Essen-Mitte
Pattbergstraße 1-3, 45239 Essen
E-Mail: specker(at)rheumanet.org
Literatur:
1 Park E et al., Arthritis Rheumatol 2020; 72(Suppl 10): Abstr. 0431 | 2 Zhu L et al., Arthritis Rheumatol 2020; 72(Suppl 10): Abstr. 0864 | 3 Papachristos D et al., Arthritis Rheumatol 2020; 72(Suppl 10): Abstr. 0983 | 4 Almeida-Brasil C et al., Arthritis Rheumatol 2020; 72(Suppl 10): Abstr. 1841 | 5 Basta F et al., Rheumatol Ther 2020; 7(3):433-446 | 6 Roccatello D et al., Arthritis Rheumatol 2020; 72(Suppl 10): Abstr. 1845 | 7 Furie R et al. A. Two-Year Results from a Randomized, Controlled Study of Obinutuzumab for Proliferative Lupus Nephritis [abstract #988]. Arthritis Rheumatol. 2020; 72 (suppl 10). | 8 Furie R et al., Ann Rheum Dis 2020; 79(Suppl1): 103 (OP0164) | 9 Furie R et al., Arthritis Rheumatol 2020; 72(Suppl 10): Abstr. 1441 | 10 Furie R et al., N Engl J Med. 2020; 383(12):1117-1128 | 11 Furie R et al., Arthritis Rheumatol 2020; 72(Suppl 10): Abstr. 0855 | 12 Merrill J et al., Arthritis Rheumatol 2020; 72(Suppl 10): Abstr. 0987 | 13 Werth V et al., Arthritis Rheumatol 2020; 72(Suppl 10): Abstr. L10 | 14 Furie R et al., Arthritis Rheumatol 2020; 72(Suppl 10): Abstr. 0935 | 15 Wallace D et al., Arthritis Rheumatol 2020; 72(Suppl 10): Abstr. 0865 | 16 Furie R et al., Lancet Rheumatol 2019; 1(4): e208-e219 | 17 Morand EF et al., N Engl J Med 2020; 382(3): 211-221 | 18 Isenberg D et al., Ann Rheum Dis 2015; 74(11): 2006-2015 | 19 Merrill JT et al., Arthritis Rheumatol 2018;70(2): 266-276 | 20 Wu D et al., Arthritis Rheumatol 2019; 71(Suppl.10): Abstr. L18 | 21 van Vollenhoven RF et al., Lancet 2018; 392(10155): 1330-1339 | 22 Wallace DJ et al., Lancet 2018; 392(10143): 222-231