Zunächst zum SLE: Hier gab es zuletzt zwei erfolgreiche Phase-III-Studien zur LN zu vermelden, BLISS-LN zu Belimumab und AURORA zu dem neuartigen Calcineurin-Inhibitor Voclosporin. In den USA sind bereits beide Therapien bei LN zugelassen worden, in Europa bislang nur Belimumab, die Zulassung von Voclosporin dürfte aber auch hier bald folgen.
SLE: Eine Einschätzung zu Anifrolumab
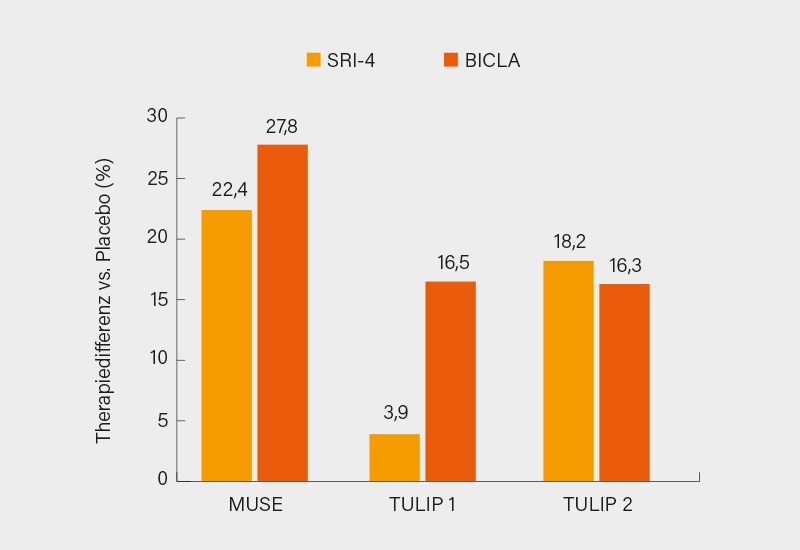
Im Wartestand befindet sich in Europa (in den USA ist er bereits zur SLE-Therapie zugelassen) noch der gegen den Typ-1-Interferon (IFN)-Rezeptor gerichtete, in zwei Phase-III-Studien geprüfte monoklonale Antikörper Anifrolumab, über den niemand geringeres als Prof. Dr. Richard Furie, New York (USA), berichtete, der an zahllosen SLE-Studien beteiligt war und ist. Der Ansatz an Typ-1-IFN ist nicht neu. Zu den verfolgten Strategien zählten zunächst mit Sifalimumab und Rontalizumab direkt gegen IFNa gerichtete Antikörper, die jedoch in Studien nicht zu überzeugen wussten, sodass im Falle von Sifalimumab die Entwicklung zugunsten von Anifrolumab aufgegeben wurde. Eine potenzielle Option könnte auch ein IFNa-Kinoid (als Vakzine) sein, das aber in einer Phase-II-Studie bei verfehltem primärem Endpunkt ebenfalls eher durchwachsene Ergebnisse lieferte. Nach ersten Daten der Phase-II-Studie MUSE waren die Erwartungen an Anifrolumab enorm hoch: Nach 52 Wochen hatten sich (allerdings ohne verpflichtendes Steroid-Tapering wie in Phase-III) die laut Furie stärksten Effektgrößen in Komposit-Indizes gegenüber Placebo in SLE-Studien gezeigt, im SRI-4-Ansprechen waren dies 22,4 % und im BICLA-Ansprechen sogar 27,8 %. Verglichen damit fielen die Unterschiede in den Phase-III-Studien TULIP-1 und -2 unter Anifrolumab 300 mg i.v. alle 4 Wochen doch eher bescheiden aus. So wurde in TULIP-1 der primäre Endpunkt eines SRI-4-Ansprechens klar verfehlt (Δ vs. Placebo 3,9 %), größer war der Unterschied mit 16,5 % im BICLA-Ansprechen, weshalb in der TULIP-2-Studie neu der BICLA als primärer Endpunkt definiert wurde. Mit einer Differenz versus Placebo von 16,3 % wurde dieser dann auch erreicht, allerdings wäre dies auch mit dem SRI-4 gelungen (Δ18,2 %). Obwohl die Diskrepanzen im SRI-4-Ansprechen zwischen beiden Studien letztlich nicht erklärbar sind (Abb. 1) und die Reduktion von Schüben nicht immer signifikant war, sieht Furie die Ergebnisse (konsistentes CLASI-Ansprechen, Reduktion von Steroiden) doch überaus positiv. Das Sicherheitsprofil ist gut, jedoch ist gehäuft mit Herpes Zoster zu rechnen (6,1 vs. 1,3 %). Wie sich Anifrolumab nach der zu erwartenden Zulassung im Therapiealgorithmus positionieren wird, bleibt derzeit noch abzuwarten.
LN: Obinutuzumab als nächster Hoffnungsträger
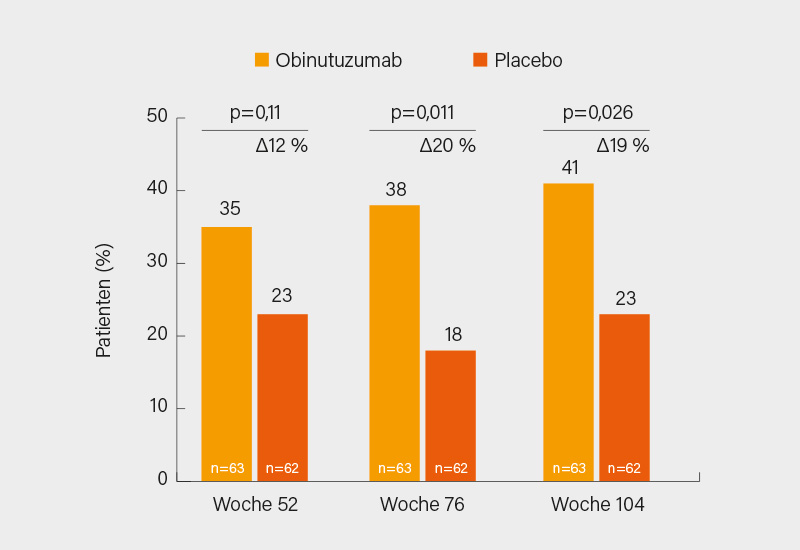
Ein großer Hoffnungsträger bei LN ist Obinutuzumab, quasi ein Rituximab der 2. Generation. Letzteres wird aufgrund seiner unbestrittenen Wirksamkeit off-label häufig eingesetzt, obwohl es aus verschiedenen Gründen in der LUNAR-Studie enttäuschte (u. a. zu kurze Studiendauer, falscher Endpunkt, inkomplette B-Zell-Depletion). Eine derzeit in mehreren Studien verfolgte Strategie für eine stärkere B-Zell-Depletion ist die (sequentielle) Kombination von Rituximab mit Belimumab (in SYNBIoSe bei schwerem refraktärem SLE, in CALIBRATE bei LN und BLISS-BELIEVE bei extra-renalem SLE). Eine weitere Option besteht in einer gegenüber Rituximab potenteren B-Zell-Depletion, wie sie der humanisierte Typ-II Anti-CD20-Antikörper Obinutuzumab ermöglicht. Die Ergebnisse der Phase-II-Studie NOBILITY (wie in LUNAR in Kombination mit MMF) waren im Hinblick auf ein komplettes renales Ansprechen (CRR) sehr gut, mit einer Differenz versus Placebo von je ca. 20 % in Woche 76 und 104, in Woche 52 war (wie in LUNAR) der Effekt noch deutlich geringer (Abb. 2). Tatsächlich fiel im Vergleich zu Rituximab in der LUNAR-Studie die B-Zell-Depletion deutlich stärker aus und korrelierte in NOBILITY mit dem Ansprechen auf Obinutuzumab. So erreichten 50 bzw. 72 % der Patienten mit anhaltender B-Zell-Depletion ein CRR respektive modifiziertes CRR. Bei gutem Sicherheitsprofil zeigt Obinutuzumab im indirekten Vergleich zu Voclosporin und Belimumab sehr gute Therapieeffekte im renalen Ansprechen. Auf die künftigen Phase-III-Ergebnisse kann man bereits sehr gespannt sein.
PSS: Erste positive Daten zu Ianalumab
Im Anschluss referierte Prof. Dr. Thomas Dörner, Berlin, über den aktuellen Status beim PSS, wo die Therapieoptionen weiter limitiert sind. Auch hier spielen Anti-B-Zell-Therapien eine wichtige Rolle, wenngleich weder Rituximab noch Belimumab in den bisherigen Studien so richtig überzeugen konnten. Die Hoffnungen ruhen derzeit insbesondere auf einer Anti-B-Zell-Therapie der 3. Generation: Ianalumab (VAY736) wirkt dual und inhibiert die Interaktion zwischen dem B-Zell-aktivierenden-Faktor (BAFF) und dem BAFF-Rezeptor und steigert zugleich die ADCC-vermittelte B-Zell-Depletion. Nach vorteilhaften Ergebnissen einer Proof-of-concept-Studie wurde kürzlich eine vierarmige Phase-IIb-Studie zu Ianalumab durchgeführt, in der Patienten mit zumindest moderater Krankheitsaktivität und Symptomen für 24 Wochen auf Ianalumab in 3 Dosierungen (s.c. 5, 50, 300 mg 1x monatlich) oder Placebo randomisiert wurden. Nach 24 Wochen konnte der primäre Endpunkt einer ESSDAI-Reduktion unter der 300-mg-Dosierung signifikant erreicht werden. Bei den sekundären Endpunkten (ESSPRI, FACIT-F) waren keine signifikanten Vorteile erkennbar, dafür jedoch – wieder unter der 300 mg-Dosierung – im stimulierten Speichelfluss und im globalen Arzturteil. Im Follow-up bis Woche 52 zeigte sich bisher ein akzeptables Sicherheitsprofil ohne opportunistische Infektionen, ca. 50 % der Teilnehmer berichteten unter der 300 mg-Dosierung über lokale Reaktionen an der Einstichstelle. Auf eine Weiterentwicklung in Phase-III ist zu hoffen, so Dörner.
SSc: Viele Ansätze, noch kein Durchbruch
Über aktuelle Entwicklungen bei SSc berichtete Prof. Dr. Ulf Müller-Ladner, Bad Nauheim. Eine neue lokale Therapieoption bei Patienten mit orofazialer Fibrose stellt die Injektion von Stammzell-angereichertem Fettgewebe dar, neben der symptomatischen Linderung kam es auch zu einer Verbesserung psychosozialer Parameter.
Erprobt werden derzeit mehrere „small molecules“. Zumindest partiell positive Ergebnisse bei diffus-kutaner SSc lieferte der sGC (lösliche Guanylat-Zyklase)-Stimulator Riociguat in einer Phase-IIb-Studie nach 52 Wochen im Hinblick auf die Haut (ΔmRSS) und Lungenfunktion (FVC). Bei SSc-assoziierter pulmonaler Hypertonie wurde u. a. auch das Prostazyklin-Analogon Treprostinil untersucht, eine gewisse Wirksamkeit bezüglich digitaler Ulzera (DU) scheint gegeben (zu 58 % komplette Abheilung aller DU), jedoch entwickelten über 20 Wochen Therapie hinweg auch 44 % der Patienten neue Ulzera. Bei Patienten mit SSc-assoziierter interstitieller Lungenerkrankung (ILD) wurde der orale direkte Thrombin-Inhibitor Dabigatran über 6 Monate getestet, positive Effekte auf die Lungenfunktion (FVC, FEV1, DLCO) waren bis dahin nicht erkennbar.
Die nach positiven Ergebnissen einer Phase-II-Studie größte Enttäuschung bot Lenabasum, ein synthetischer Cannbinoid-Rezeptor-Typ2-(CB2)-Agonist, der auch in anderen Indikationen geprüft wird und sowohl gegen die Fibrose als auch Inflammation wirken soll. Während sich in der Phase-II-Studie nach 16 Wochen sowohl eine Besserung der Komposit-Scores ACR CRISS als auch des mRSS fand, wurde in der Phase-III-Studie RESOLVE-1 der primäre Endpunkt (ACR CRISS) ebenso wie die sekundären Endpunkte klar verfehlt. Die Therapie erfolgte bei 84 % der Patienten on top anderer Immunsuppressiva, die ihrerseits bereits so gut wirkten (sehr hoher ACR CRISS-Score von 0,887, max. 1), dass kein additiver Effekt von Lenabasum nachweisbar war.
Nun zu den Biologika: Weiterhin unklar ist trotz mehrerer Phase-II/III-Studien der Stellenwert von Abatacept, das speziell bei längerem Follow-up einen gewissen (mRSS, HAQ-DI), aber doch überschaubaren Nutzen zeigt. Für die Zukunft interessanter erscheint Romilkimab, ein humanisierter, bispezifischer IgG4-Antikörper gegen profibrotisches Interleukin (IL)-4 und IL-13. Nach 24 Wochen zeigte sich in einer Proof-of-concept-Studie eine klare Verbesserung im primären Endpunkt (mRSS). Eine fäkale Mikrobiom-Transplantation erwies sich bei SSc-Patienten als sicher, die rektale Inkontinenz besserte sich jedoch nur im Trend. An interessanten Ansätzen mangelt es also nicht, ein großer Durchbruch ist derzeit aber nicht in Sicht, konstatierte Müller-Ladner.
Quelle: Plenarsitzung „Neue Behandlungskonzepte bei Systemerkrankungen“, DGRh-Kongress, 17. September 2021