Mit der Frage, ob sich durch eine frühe Intervention im Stadium einer klinisch verdächtigen Arthralgie (CSA) die Entwicklung zur manifesten RA stoppen lässt, hatten sich bereits einige randomisierte, kontrollierte Studien beschäftigt. So lieferten die PRAIRI-Studie zu Rituximab und zuletzt die ARIAA-Studie mit Abatacept durchaus Hinweise für zumindest eine Verzögerung der RA, waren aber nicht ganz konklusiv. Ein von Jürgen Rech, Erlangen, und Kollegen präsentiertes Update zu ARIAA, einer Studie, in der 100 ACPA- und MRT-positive Patienten 6 Monate Abatacept erhalten hatten, ergab, dass diese 12 Monate nach dem Stopp von Abatacept häufiger keine RA entwickelten (35 vs. 57 %; p=0,0421). (1)
TREAT EARLIER: Methotrexat als vertraute Ersttherapie
Noch interessanter erscheint der von Doortje Krijbolder, Leiden (Niederlande), und Kollegen in der randomisierten, doppelblinden, 2-jährigen Proof-of-concept-Studie TREAT EARLIER verfolgte Ansatz: Hierin wurden 236 Patienten mit CSA und subklinischer Entzündung im MRT im Verhältnis 1:1 auf eine i.m. Glukokortikoid (GK)-Injektion (120 mg) und 12 Monate MTX (bis zu 25 mg/Tag) oder Placebo randomisiert und in einem 12-monatigen Follow-up (ohne Therapie) nachverfolgt. Primärer Endpunkt war die Entwicklung einer persistierenden (≥2 Wochen) klinischen Arthritis (gemäß RA-Kriterien 2010 oder ≥2 betroffene Gelenke). Die sekundären Endpunkte waren der HAQ, Morgensteifigkeit, Schmerzen und Präsentismus, überdies wurden MRT-Parameter (Tenosynovitis, Synovitis, Osteitis) im RAMRIS-Score erfasst. Im Ergebnis war das Arthritis-freie Überleben nach 24 Monaten vergleichbar (80 vs. 82 %, Hazard ratio, HR 0,81). Der HAQ verbesserte sich unter MTX in den ersten Monaten stärker und blieb auch über 2 Jahre signifikant besser (-0,1; p=0,004), selbiges galt für Schmerzen (-9 auf Skala 0-100; p<0,001), Morgensteifigkeit (-12; p<0,001) und Präsentismus (-8 %; p=0,001). Auch die Gelenkentzündung im MRT zeigte sich über 2 Jahre verbessert (im Mittel -1,4 Punkte; p<0,001). In einer Subgruppe von Hochrisiko-Patienten für RA wurde die Entwicklung zu einer solchen unter Therapie verzögert, nach 24 Monaten bestand aber kein Unterschied (je
67 %). Ähnlich war dies bei ACPA-positiven Patienten, von denen 48 vs. 52 % eine persistierende klinische Arthritis entwickelten. Insgesamt misslang der Nachweis einer Prävention der RA, eine Modifizierung des Krankheitsverlaufs wurde unter MTX in der prä-arthritischen Phase der RA jedoch erreicht. (2) Die Studie liefert die bislang wohl beste Evidenz für die Vertretbarkeit einer solchen frühen Intervention.
Neues zur RA aus NORD-STAR, MIRACLE und GLORIA
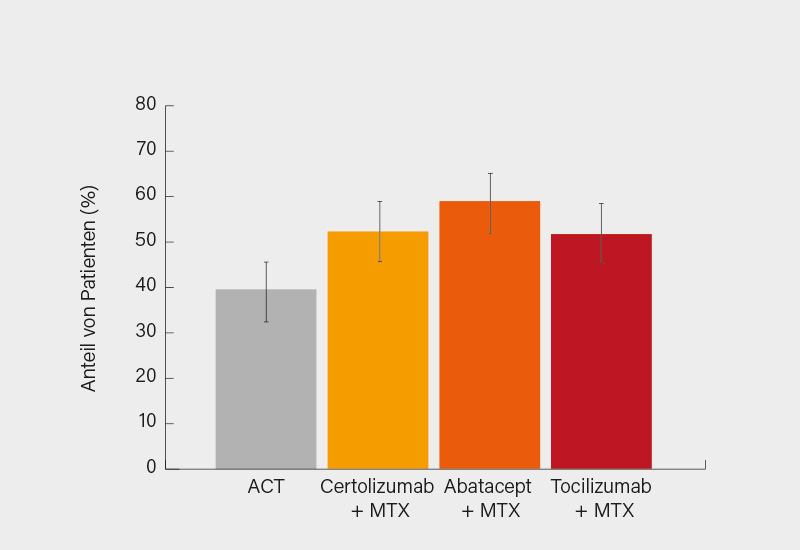
Über die 48-Wochen-Ergebnisse der randomisierten, kontrollierten NORD-STAR-Studie zur First-line-Therapie bei früher RA berichteten Mikkel Østergaard, Glostrup (Dänemark), und Kollegen. In der großen skandinavischen Studie wurden 812 Patienten mit früher, therapienaiver RA (DAS28 >3,2 und RF/ACPA+/CRP >10 mgl) im Verhältnis 1:1:1:1 auf MTX kombiniert mit entweder GK (mit Ausschleichen bis Woche 36) oder Sulfasalazin, Hydroxychloroquin und i.a.-GK-Injektionen (=aktive konventionelle Therapie, ACT), Certolizumab Pegol, Abatacept oder Tocilizumab randomisiert, ko-primäre Endpunkte in Woche 48 waren eine CDAI-Remission ≤2,8 und die Veränderung der Röntgenprogression ab Baseline (ΔvdHSS). Eine Remission in Woche 48 erreichten 59,3 % (MTX plus Abatacept), 52,3 % (MTX plus Certolizumab), 51,9 % (MTX plus Tocilizumab) und 39,2 % der Patienten mit der ACT (Abb.). Ein Nachweis der signifikanten Überlegenheit gegenüber der ACT wurde für Abatacept (adj. Differenz +20,1 %; p<0,001) und Certolizumab (+13,1 %; p=0,021), aber nicht Tocilizumab (+12,7 %; p=0,030) erbracht. Bei der (nur sehr geringen) Röntgenprogression zeigten sich keine relevanten Unterschiede. (3) Bei vernachlässigbaren Unterschieden in der Sicherheit spricht dennoch viel für das übliche Vorgehen, erst im zweiten Schritt MTX um ein bDMARD zu ergänzen.
Nachdem bei MTX/bDMARD-naiven Patienten bereits vor Jahren gezeigt wurde, dass in der Kombination aus Adalimumab und MTX eine niedrigere MTX-Dosis (10 vs. 20 mg) ähnlich gute Ergebnisse liefert, wurde dies in der randomisierten, kontrollierten MIRACLE-Studie nun auch bei 291 MTX-vorbehandelten Patienten (max. 25 mg als Monotherapie für 24 Wochen) mit früher RA bestätigt. Laut Hiroya Tamai, Tokyo (Japan), und Kollegen erhielten diese bei einem SDAI ≤3,3 weiter MTX oder wurden bei einem SDAI >3,3 für 24 Wochen mit Adalimumab 40 mg alle 2 Wochen plus MTX 10-25 mg oder MTX 6-8 mg (im Mittel 13,2 vs. 7,6 mg) behandelt. Den primären Endpunkt einer SDAI-Remission erreichten nach 48 Wochen mit 38,4 und 44,8 % vergleichbar viele Patienten, die Nicht-Unterlegenheit der niedrigeren MTX-Dosis (dies galt auch für den HAQ und die Röntgenprogression) anzeigend. (4) Direkt übertragbar sind die Daten dieses rein asiatischen Kollektivs nicht, jedoch kann in Kombination mit einem bDMARD wohl tatsächlich eine niedrigere MTX-Dosis von ca. 10 mg gewählt werden.
Noch für viele Diskussion sorgen dürfte die von Maarten Boers, Amsterdam (Niederlande), und Kollegen vorgestellte pragmatische, randomisierte, placebokontrollierte GLORIA-Studie, in der über 2 Jahre eine Add-on-Therapie mit GK (Prednisolon 5 mg/Tag) mit Placebo bei 451 Patienten >65 Jahre (im Mittel 72 Jahre, 2,1 Komorbiditäten) mit etablierter RA (Krankheitsdauer im Mittel 11 Jahre, DAS28 4,5, 90 % mit Gelenkschäden) verglichen wurde (79 % auf DMARD-Therapie, davon 14 % auf einem bDMARD). Die Studie schlossen 63 (Low-dose-GK) bzw. 61 % der Patienten ab. Nach 2 Jahren hatten die GK-Patienten einen signifikant niedrigeren DAS28 (-0,37 Punkte; p<0,0001) und geringere Progression von Gelenkschäden (-1,7 Punkte; p=0,003), wobei sich die Vorteile des GK vor allem im ersten Jahr zeigten. Erkauft wurde dies mit 24 % mehr unerwünschten Ereignissen, überwiegend handelte es sich um nicht-schwere Infektionen. (5) Die Autoren der kürzlich veröffentlichten Studie (6) werten die Ergebnisse als Argument zugunsten einer langfristigen Low-dose-GK-Therapie bei älteren RA-Patienten, dies kann man sicher auch anders sehen und sich die Frage stellen, ob nicht auch in diesem Kollektiv eine bessere Versorgung mit bDMARDs nicht die bessere Wahl wäre.
Kurz und kompakt
Dass eine therapiebedürftige Depression bei RA-Patienten mit einem 6-fach erhöhten Sterblichkeitsrisiko assoziiert ist, wiesen Jens Kristian Pedersen, Odense (Dänemark), und Kollegen in einem RA-Kollektiv des DANBIO-Registers nach. Von 11.071 Patienten hatten 10 % ein Antidepressivum erhalten, überwiegend Frauen (71 %) und solche mit seropositiver RA (61 %). Am höchsten war das adjustierte Mortalitätsrisiko bei unter 55-Jährigen (HR 6,66). Nach 10 Jahren zeigte sich eine kumulative Sterblichkeit von 37,5 vs. 12,5 % bei RA-Patienten mit und ohne Depression. (7) Hinzuweisen ist auch auf eine gut gemachte Studie von Giovanni Adami, Verona (Italien), und Kollegen zum Risiko von Luftverschmutzung (i. e. Feinstaubbelastung) für die Entwicklung von Autoimmunerkrankungen (AID). Die chronische Exposition auf Feinstaub PM10 war nach Adjustierung mit einem erhöhten Risiko für RA (Odds ratio, OR 1,41), aber nicht anderen AID assoziiert, hohe PM2.5-Werte ebenfalls mit einem erhöhten Risiko für RA (OR 1,56), aber auch Kollagenosen und chronisch-entzündliche Darmerkrankungen. (8)
Quellen:
1 Ann Rheum Dis 2022; 81(Suppl 1): 526 (Poster POS0531)
2 Ann Rheum Dis 2022; 81(Suppl 1): 48-49 (Abstr. OP0070)
3 Ann Rheum Dis 2022; 81(Suppl 1): 38-40 (Abstr. OP0058)
4 Ann Rheum Dis 2022; 81(Suppl 1): 42-43 (Abstr. OP0062)
5 Ann Rheum Dis 2022; 81(Suppl 1): 180 (Abstr. OP0270)
6 Ann Rheum Dis 2022; doi: 10.1136/annrheumdis-2021-221957
7 Ann Rheum Dis 2022; 81(Suppl 1): 46-47 (Abstr. OP0067)
8 Ann Rheum Dis 2022; 81(Suppl 1): 49-50 (Abstr. OP0071)