Update der GRAPPA-Empfehlungen zur PsA-Therapie
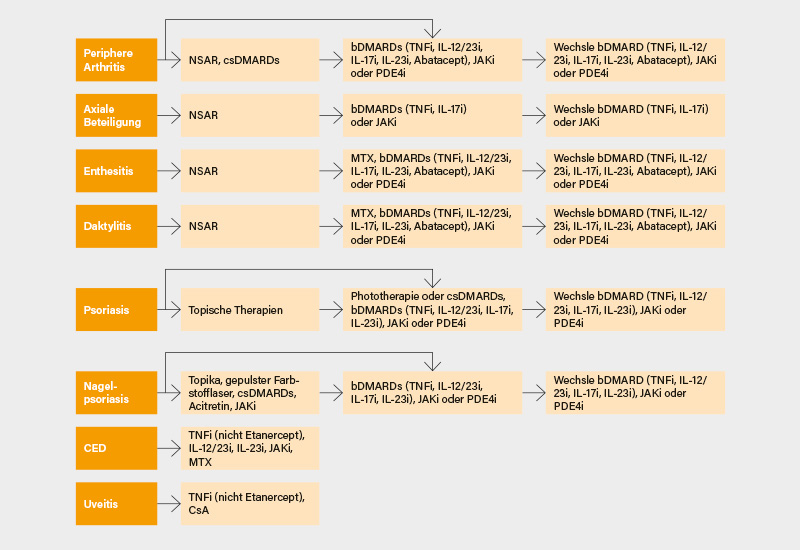
Auf dem Kongress wurden erstmals die neuen GRAPPA (Group for Research and Assessment of Psoriasis and Psoriatic Arthritis)-Empfehlungen für die Behandlung der PsA vorgestellt. Die Empfehlungen sind noch nicht publiziert, somit sind gewisse Abweichungen von der finalen Version möglich, die Haupaussagen werden jedoch mit einer großen Wahrscheinlichkeit bleiben. Seit dem letzten Update 2015 sind viele neue Medikamente im Rahmen von klinischen Studien in der Indikation PsA untersucht worden, so z. B. JAK- und IL-23-Inhibitoren. Zusätzliche Ergebnisse für ältere Medikamente, wie Methotrexat (MTX) oder Apremilast, wurden in allen PsA-Domänen veröffentlicht. Basierend auf der Evidenz wurden nunmehr aktualisierte Behandlungsempfehlungen in das Gesamtschema eingearbeitet, das Grundsätze für das Management von Arthritis, axiale Manifestationen, Enthesitis, Daktylitis, Haut- und Nagelerkrankungen bei PsA und assoziierten Erkrankungen (Uveitis, CED) enthält (Abb. 1).
Die Wahl der Therapie für einen einzelnen Patienten sollte idealerweise alle Bereiche berücksichtigen, die sich auf den betroffenen Patienten auswirken, und die gemeinsame Entscheidungsfindung mit diesem unterstützen. In den Empfehlungen wurden zusätzlich die wichtigsten Begleiterkrankungen und Komorbiditäten berücksichtigt, da diese oft die Wahl der Therapie beeinflussen. (1)
Stuhltransplantation bei PsA: Viele offene Fragen
Im Rahmen einer Plenarsitzung wurden Ergebnisse einer Studie zur FMT vorgestellt. In dieser doppelblinden kontrollierten Studie wurden Erwachsene mit aktiver peripherer PsA (≥3 geschwollene Gelenke) trotz laufender Behandlung mit MTX zufällig im Verhältnis 1:1 einer gastroskopisch gesteuerten FMT (von einem gesunden Stuhlspender) oder einer Scheintransplantation in den Zwölffingerdarm zugeteilt. Der primäre Wirksamkeitsendpunkt war der Anteil der Teilnehmer, die nach 26 Wochen ein Therapieversagen erlitten (d. h. eine Intensivierung der Behandlung benötigten). Insgesamt wurden 31 Patienten randomisiert (15 wurden der FMT zugewiesen), alle erhielten die zugewiesene Intervention. Ein Therapieversagen trat in der FMT-Gruppe häufiger auf als in der Sham-Gruppe (9 [60%] vs. 3 [19%]). Zusammenfassend war dies ein überraschendes Ergebnis, das eindeutig gezeigt hat, wie wenig wir über die Rolle der Mikrobiota bei der Entstehung der PsA und SpA wissen. Die Schwachstellen der Studie waren eine kleine Fallzahl und die Anwendung von unüblichen Endpunkten (Therapieversagen statt Ansprechkriterien). (2)
Oraler TYK-2-Inhibitor in Phase-II-Studie geprüft
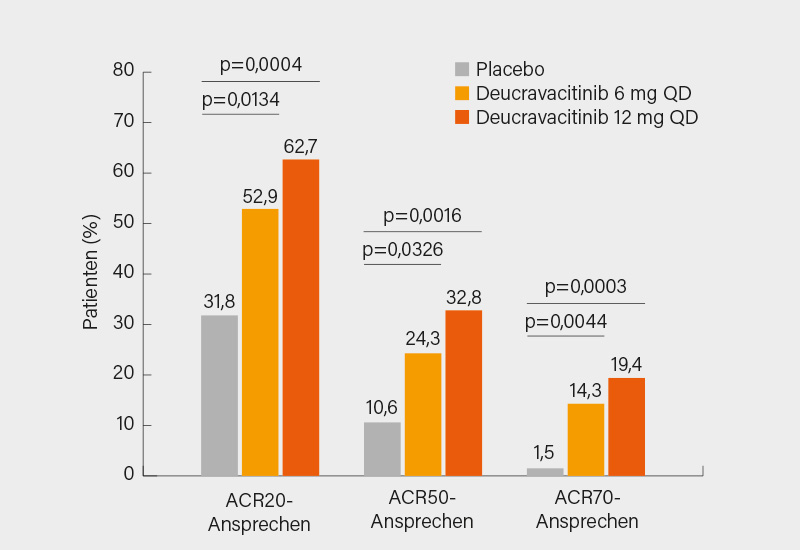
Die Tyrosinkinase-2 ist eine intrazelluläre Kinase, die bei den Signalwegen der Zytokine wie IL-23-, IL-12- und Interferon (IFN)-a/b beteiligt ist und somit ein potenzielles Zielmolekül bei PsA und SpA darstellt. Deucravacitinib ist ein oraler selektiver TYK2-Inhibitor, der im Rahmen einer Phase-II-Studie bei der PsA untersucht wurde. Patienten mit aktiver Erkrankung (≥3 schmerzhafte Gelenke, ≥3 geschwollene Gelenke, C-reaktives Protein [CRP] ≥3 mg/L) und mindestens einer aktiven psoriatischen Hautläsion wurden 1:1:1 auf Deucravacitinib 6 mg täglich oder 12 mg täglich (QD) oder Placebo randomisiert. Patienten, die mit Deucravacitinib behandelt wurden, erreichten in Woche 16 signifikant häufiger ein ACR20- (primärer Endpunkt) sowie ACR50/70-Ansprechen im Vergleich zu den Placebo-behandelten Patienten (Abb. 2). Verbesserungen für Deucravacitinib 6 mg und 12 mg QD im Vergleich zu Placebo wurden in allen ACR-Komponenten beobachtet, wobei eine offensichtliche Trennung bereits in Woche 4 auftrat, z. B. beim HAQ-DI und CRP. Auch im PASI 75-Ansprechen war Deucravacitinib Placebo überlegen. Das sind vielversprechende Ergebnisse, die im Rahmen von Phase-III-Studien noch bestätigt werden sollen. Die Konkurrenz bei der PsA ist allerdings groß, weshalb man sich schon früh über die richtige Platzierung der Substanz Gedanken machen sollte. Zudem stellt sich die Frage, ob und inwieweit Deucravacitinib auch bei der axialen SpA wirksam sein könnte. (3)
Nächster IL-23-Inhibitor mit positiven Phase-III-Daten
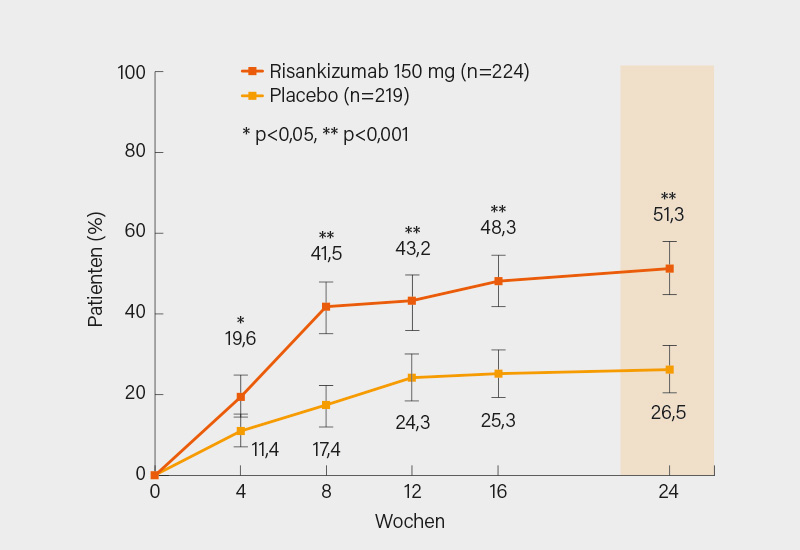
Eine weitere Substanz, die bald das rheumatologische Armamentarium bei der Behandlung der PsA bereichern dürfte, ist Risankizumab – ein monoklonaler Antikörper gegen die p19-Einheit von IL-23. Somit werden – wie bei Guselkumab – nur die biologischen Effekte von IL-23 (und nicht von IL-12, was bei Ustekinumab der Fall ist) unterbunden. In der Phase-III-Studie KEEPsAKE 2 wurden die Wirksamkeit und Sicherheit von Risankizumab versus Placebo zur Behandlung von aktiver PsA bei Patienten, die auf 1 oder 2 Biologika (bDMARD-IR) oder auf ≥1 csDMARD unzureichend angesprochen oder diese nicht vertragen haben. Erwachsene Patienten mit aktiver PsA (≥5 schmerzhafte und ≥5 geschwollene Gelenke) wurden randomisiert, um entweder s.c. Risankizumab 150 mg oder Placebo in den Wochen 0, 4 und 16 zu erhalten. Es wurden 443 Patienten (Risankizumab, n=224; Placebo, n=219) in die Analyse einbezogen, 206 (46,5 %) waren bDMARD-IR. Signifikant größere Anteile der mit Risankizumab im Vergleich zu mit Placebo behandelten Patienten erreichten den primären Endpunkt, das ACR20-Ansprechen in Woche 24 (51,3 vs. 26,5 %; p<0,001) (Abb. 3), und die wichtigsten sekundären Endpunkte. Auch bei Risankizumab wird die Frage der richtigen Platzierung im therapeutischen Algorithmus der PsA sehr wichtig sein. (4)
Biologika-refraktäre Verläufe bei axSpA im Fokus
Kollegen aus Nordeuropa haben sich mit dem Problem von Biologika-refraktären Verläufen bei axialer SpA beschäftigt. Hierfür wurden Daten 5 großer Register-Studien ausgewertet. Die refraktäre Erkrankung wurde anhand der Anzahl der Biologika-Behandlungen definiert, die bei einzelnen Patienten begonnen wurden: mild (≤3 Biologika), moderat (≤4) und streng (≥5). Unter den 12.037 eingeschlossenen axSpA-Patienten betrug die Punktprävalenz der Biologika-refraktären Erkrankung im Jahr 2018 16, 7 und 3 % nach den drei aufgeführten Definitionen. Bei Beginn des 1. Biologikums waren die Patienten, die später die Definitionen für refraktäre axSpA erfüllten, häufiger Frauen, hatten eine kürzere Krankheitsdauer, ein höheres CRP und höhere patientenberichtete Outcomes. Diese Studie zeigte, dass ein Biologika-refraktärer Verlauf ein relevantes Problem bei der axialen SpA darstellt. Bei dem ausgewählten Analyseverfahren waren jedoch Patienten nicht berücksichtigt, die keine ausreichende Kontrolle der Symptome aufweisen, aber langfristig beim 1. oder 2. Biologikum bleiben – dadurch kann die Anzahl der Biologika-refraktären Verläufe unterschätzt sein. Gleichzeitig ist das Problem Biologika-refraktärer Fälle bei der axSpA recht komplex – neben den Patienten mit persistierender entzündlicher Aktivität stellen jene mit nicht-entzündlichen Ursachen von Schmerzen bzw. Symptomen (mechanische Probleme in der Wirbelsäule, zentrale Sensitivierung, etc.) eine große Herausforderung im klinischen Alltag dar. (5)
GESPIC: Zeitverzögerte Effekte von Anti-TNF-Therapien
Sehr lange herrschte eine große Unsicherheit, ob Biologika-Therapien (insbesondere mit TNFα-Inhibitoren) die Entstehung struktureller Schäden in der Wirbelsäule (röntgenologische Progression) bei axSpA aufhalten könnten. Die ersten Studien zeigten, dass eine 2-jährige Therapie mit einem TNFα-Inhibitor keine relevante Reduktion der röntgenologischen Progression bringen konnte. In den darauf folgenden Studien gab es Hinweise, dass eine längere Therapiedauer notwendig sein kann, um eine Verlangsamung der strukturellen Progression zu erreichen.
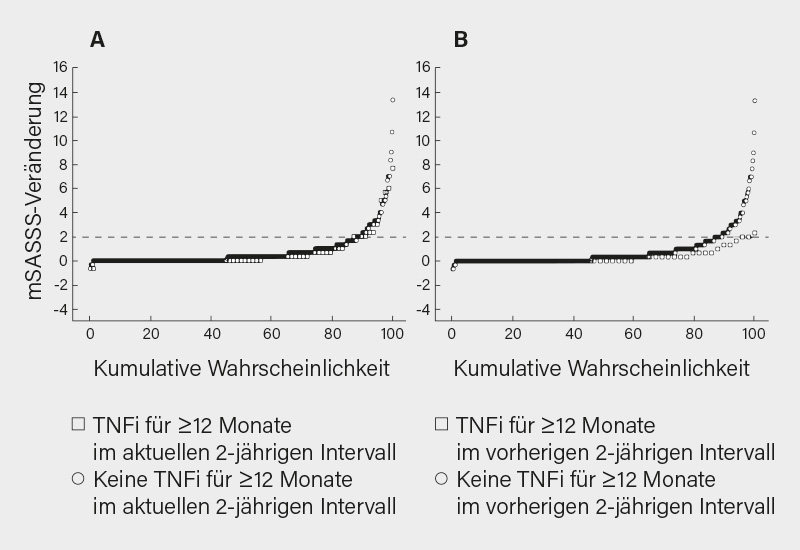
Auf dem EULAR-Kongress wurden Daten zur röntgenologischen Progression unter Anti-TNF-Therapien aus GESPIC (German Spondyloarthritis Inception Cohort) präsentiert. Insgesamt wurden 266 Patienten mit früher axSpA (röntgenologische axSpA [r-axSpA] und Symptomdauer ≤10 Jahre oder nicht-röntgenologische axSpA [nr-axSpA] mit Symptomdauer ≤5 Jahre) aus GESPIC mit mindestens zwei Sätzen von Röntgenaufnahmen der Wirbelsäule, die im Abstand von mindestens 2 Jahren während eines 10-Jahres-Follow-ups gewonnen wurden, eingeschlossen. Diese Patienten steuerten insgesamt 542 2-jährige Röntgenintervalle bei. Die Röntgenbilder der Wirbelsäule wurden von drei geschulten und kalibrierten Readern nach dem modifizierten Stoke Ankylosing Spondylitis Spine Score (mSASSS) ausgewertet. Die röntgenologische Progression in der Wirbelsäule bei axSpA-Patienten, die im aktuellen 2-jährigen Intervall TNFα-Inhibitoren erhielten, unterschied sich nicht von der Progression bei Patienten, die nicht damit behandelt wurden, während eine Anti-TNF-Therapie im vorangegangenen 2-jährigen Intervall mit einer geringeren Progression im Vergleich zu Patienten ohne TNFα-Inhibitoren in diesem Intervall verbunden war (Abb. 4). (6) So ein zeitverzögerter Effekt kann wahrscheinlich bei allen wirksamen antientzündlichen Medikamenten beobachtet werden, wenn die Verlangsamung der strukturellen Progression mit antientzündlicher Wirkung und nicht mit direkter Hemmung der Knochenneubildung verbunden ist. Auch bei den Sakroiliakalgelenken wurde in GESPIC ein zeitverzögerter Effekt von TNFα-Inhibitoren auf die röntgenologische Progression bei axSpA beobachtet. (7)
Neue Erkenntnisse zur JAK-1-Inhibition bei r-axSpA
Seit einigen Monaten ist der JAK-1-Inhibitor Upadacitinib für die Behandlung der r-axSpA zugelassen. Es wurden auch positive Studiendaten zu dem Pan-JAK-Inhibitor Tofacitinib (Phase-II- und III-Studien) sowie dem JAK-1-Inhibitor Filgotinib (Phase-II) publiziert. Auf dem EULAR-Kongress wurden nun MRT-Daten aus der Phase-II-Studie TORTUGA zu Filgotinib bei r-axSpA präsentiert. MRT-Bilder von 88 Patienten (Filgotinib, n=47; Placebo, n=41) von Baseline und Woche 12 (oder nach vorzeitiger Beendigung) wurden ausgewertet. Der Gesamtscore der Osteitis in der Wirbelsäule verringerte sich unter Filgotinib gegenüber dem Ausgangswert, nicht aber unter Placebo (p=0,0003 für den Unterschied zwischen den Gruppen). Somit konnte gezeigt werden, dass die JAK-1-Blockade bei r-axSpA mit einer echten antientzündlichen Wirkung einhergeht. Die exakten biologischen Mechanismen von diesem Effekt müssen noch gezeigt werden, präklinische Daten suggerieren aber, dass die JAK-1-Blockade zu einer deutlichen Reduktion der Expression mehrerer proentzündlicher Zytokine (hierunter auch solche, die für die Pathogenese der SpA relevant sind) führt. Trotz der klinischen und MRT-Wirksamkeit von Filgotinib ist momentan unklar, ob diese Substanz bei der axSpA überhaupt zugelassen wird. (8)
Prof. Dr. med. Denis Poddubnyy
Leiter der Rheumatologie am Campus Benjamin Franklin – Medizinische Klinik für Gastroenterologie,
Infektiologie und Rheumatologie
Charité – Universitätsmedizin Berlin
Hindenburgdamm 30, 12203 Berlin
Quellen: 1 Coates LC et al., Ann Rheum Dis 2021; 80(Suppl1): 139-140 (OP0229) | 2 Skov Kragsnaes M et al., Ann Rheum Dis 2021; 80(Suppl1): 6 (OP0010) | 3 Mease PJ et al., Ann Rheum Dis 2021; 80(Suppl1): 137-138 (OP0227) | 4 Ostor A et al., Ann Rheum Dis 2021; 80(Suppl1): 138-139 (OP0228) | 5 Di Giuseppe D et al., Ann Rheum Dis 2021; 80(Suppl1): 82-83 (OP0140) | 6 Poddubnyy D et al., Ann Rheum Dis 2021; 80(Suppl1): 81-82 (OP0139) | 7 Torgutalp M et al., Ann Rheum Dis 2021; 80(Suppl1): 80 (OP0137) | 8 Baraliakos X et al., Ann Rheum Dis 2021; 80(Suppl1): 83-84 (OP0141)