AxSpA: Update der ASAS-EULAR Behandlungsempfehlungen
Auf dem Kongress wurden erstmalig die neuen ASAS/EULAR-Empfehlungen für die Behandlung der axialen SpA vorgestellt. Wie in der bisherigen Version wird auch in der aktuellen Leitlinie das gesamte Spektrum einschließlich der nicht-röntgenologischen und röntgenologischen (nr-/r-) axSpA abgedeckt. NSAR bleiben die pharmakologische Therapie der ersten Wahl, gefolgt von TNF-, IL-17- oder JAK-Inhibitoren. Die JAK-Inhibitoren sind neu im Behandlungsalgorithmus und wurden entsprechend dem Zulassungsstatus auf die gleiche Stufe mit TNF- und IL-17-Inhibitoren platziert, es wird jedoch auf die übliche Praxis mit dem vorrangigen Einsatz von TNF- und IL-17-Inhibitoren nach NSAR-Versagen verwiesen. Zudem wurde die vorrangige Rolle des ASDAS für die Beurteilung der Krankheitsaktivität und des Therapieansprechens gestärkt. Neu ist außerdem die Betonung der Rolle von extramuskuloskelettalen Manifestation bei der Wahl der Therapie (z. B. monoklonale Antikörper gegen TNF bei der anterioren Uveitis und chronisch-entzündlichen Darmerkrankungen [CED], IL-17-Inhibitoren bei einem klinisch relevanten Hautbefall im Rahmen der Psoriasis). Bei fehlendem Ansprechen auf die Therapie sollte als erstes die Diagnose (bzw. die Ursachen von persistierenden Beschwerden) überprüft werden. Nur wenn eine aktive axSpA bestätigt werden kann, sollte ein Wechsel auf ein anderes Medikament (aus der gleichen oder anderen Gruppe) erfolgen. Bei einer stabilen Remission (über 6 Monate oder länger) kann eine Therapiedeeskalation im Falle von TNF- oder IL-17-Inhibitoren versucht werden; zu den JAK-Inhibitoren konnte hierbei (wegen fehlender Daten) keine Empfehlung ausgesprochen werden. (1)
Instrumente im Core Set für die Beurteilung der axialen SpA
Im letzten Jahr wurden die Domänen des 20 Jahre alten Core Outcome Set für axSpA aktualisiert. Im nächsten Schritt wurden die konkreten Instrumente für die jeweiligen Domänen definiert. Zum aktualisierten Core Set gehören sieben Instrumente für sechs Bereiche, die für alle Studien obligatorisch sind: ASDAS und globale Beurteilung der Krankheitsaktivität durch den Patienten auf einer numerischen Ratingskala (NRS) für die Krankheitsaktivität, Rückenschmerzen auf NRS für Schmerzen, Schweregrad und Dauer der Morgensteifigkeit kombiniert für die Morgensteifigkeit, Fatigue auf NRS für Müdigkeit, BASFI für die körperliche Funktion und der ASAS Health Index für die globale Funktionsfähigkeit und Gesundheit. Es gibt 9 zusätzliche Instrumente für Studien mit DMARDs: zwei MRT-Scores (SPARCC für die Sakroiliakalgelenke [SIG] und für die Wirbelsäule) für die Krankheitsaktivität, die drei extramuskuloskelettalen Manifestationen Uveitis, CED und Psoriasis, die gemäß den ASAS-Empfehlungen erfasst werden, die drei peripheren Manifestationen (Anzahl geschwollener Gelenke aus 44, MASES und Anzahl der Finger oder Zehen mit Daktylitis) und der modifizierte Stoke Ankylosing Spondylitis Spine Score (mSASSS) für strukturelle Schäden. Darüber hinaus wurden 11 weitere Instrumente von der ASAS gebilligt und können zusätzlich in axSpA-Studien verwendet werden: BASDAI, CRP, Berlin MRT-Scores für die Krankheitsaktivität, nächtliche Schmerzen auf NRS, Schweregrad (BASDAI Frage 5) und Dauer (BASDAI Frage 6) der Morgensteifigkeit, SF-36 für die allgemeine Funktionsfähigkeit und Gesundheit, Anzahl geschwollener Gelenke (aus 66) und SPARCC Enthesitis für periphere Manifestationen und MRT-Erosionenscore (SPARCC SSS) für strukturelle Schäden. Es ist davon auszugehen, dass die genannten Instrumente den Standard für die Beurteilung der Wirksamkeit von Medikamenten in den nächsten Jahren bilden werden. (2)
Können NSAR die radiografische Progression verlangsamen?
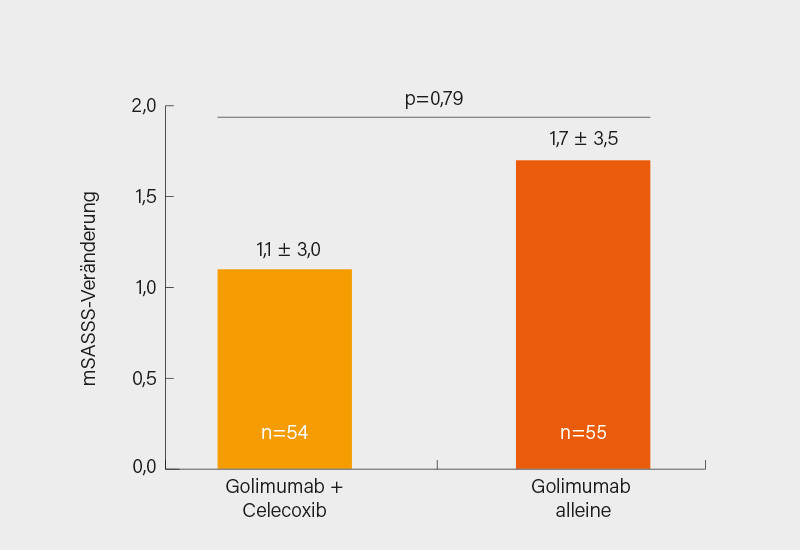
Mit dieser klinisch relevanten Frage haben sich zwei EULAR-Beiträge beschäftigt. Im ersten wurden die Ergebnisse der randomisierten, kontrollierten CONSUL-Studie vorgestellt. Deren Ziel war es, die Effekte einer Behandlung mit dem COX-2-selektiven NSAR Celecoxib (CEL) in Kombination mit dem TNF-Inhibitor Golimumab (GOL) im Vergleich zum TNF-Inhibitor (GOL) allein auf das Fortschreiten struktureller Schäden an der Wirbelsäule (röntgenologische Progression) über einen Zeitraum von 2 Jahren bei Patienten mit r-axSpA zu untersuchen. Eingeschlossen wurden Patienten mit r-axSpA und hoher Krankheitsaktivität (BASDAI ≥4), NSAR-Versagen und Risikofaktoren für eine röntgenologische Progression in der Wirbelsäule: CRP >5 mg/l und/oder ≥1 Syndesmophyt(en). Die Studie bestand aus zwei Phasen: einer 12-wöchigen Run-in-Phase, in der alle eingeschlossenen Patienten mit GOL 50 mg alle 4 Wochen s.c. behandelt wurden, gefolgt von einer 96-wöchigen kontrollierten Behandlungsphase, in der Patienten, die eine BASDAI-Verbesserung von ≥2 Punkten erreichten, nach dem Zufallsprinzip den Armen GOL + CEL 2x 200 mg/Tag (BID) oder GOL allein zugeteilt wurden. Der primäre Endpunkt war die röntgenologische Progression in der Wirbelsäule, die anhand der Veränderung im mSASSS nach 108 Wochen bewertet wurde. Insgesamt wurden 128 Patienten in die Run-in-Phase aufgenommen. 109 Patienten erfüllten das BASDAI-Ansprechkriterium in Woche 12 und wurden im Verhältnis 1:1 (54 vs. 55) auf GOL + CEL oder GOL allein randomisiert; 97 (45 vs. 52) Patienten schlossen die Studie in Woche 108 ab. Die mSASSS-Veränderung nach 108 Wochen betrug 1,1 (±3,0) bzw. 1,7 (±3,5) in den Gruppen GOL + CEL bzw. GOL allein (p=0,79) (Abb. 1). Neue Syndesmophyten traten bei 11 bzw. 25 % der Patienten in den Gruppen GOL + CEL bzw. GOL allein auf (p=0,12). (3)
In der zweiten Arbeit wurde der Einfluss von NSAR (sowohl von selektiven COX-2- als auch von nicht-selektiven COX-Inhibitoren) auf die röntgenologische Progression in der Wirbelsäule bei axSpA-Patienten in der GESPIC-Kohorte untersucht. Auf der Grundlage der Verfügbarkeit von mindestens zwei Sätzen von Röntgenaufnahmen der Wirbelsäule während der 10-jährigen Nachbeobachtung wurden 243 Patienten mit axSpA (130 mit nr- und 113 mit r-axSpA) in diese Analyse einbezogen. Die Patienten lieferten insgesamt 540 2-Jahres-Röntgenintervalle, die mittels mSASSS bewertet wurden. NSAR-Typ, Tagesdosis und Häufigkeit der Einnahme wurden bei den Besuchen erfasst. Der ASAS-Index der NSAR-Einnahme (0-100), der sowohl die Dosis als auch die Dauer der Einnahme berücksichtigt, wurde für die Intervalle berechnet. Ein signifikanter Zusammenhang zwischen einer höheren NSAR-Einnahme und einer Verzögerung des radiologischen Fortschreitens der Wirbelsäule wurde in einer bereinigten multivariablen GEE-Längsschnittanalyse festgestellt. Dieser Effekt war hauptsächlich Patienten mit r-axSpA zuzuschreiben. Die mSASSS-Progression war bei Patienten, die COX-2 Inhibitoren (unabhängig von der Dosis) einnahmen, numerisch niedriger als bei Patienten, die mit nicht-selektiven NSAR behandelt wurden. (4)
Zusammenfassend liefern die beiden Studien neue Evidenz über den Effekt von NSAR (und insbesondere von COX-2-Inhibitoren) auf die radiografische Progression bei der axSpA. Insgesamt scheint der Effekt allerdings nicht sehr groß zu sein, weshalb man weiterhin die NSAR-Gabe nur bei axSpA-Patienten empfiehlt, die eine klinische Indikation (d. h. Symptome wie Schmerz und Steifigkeit) für diese Medikamentengruppe haben.
IL-17A/F-Blockade zeigt positivePhase-III-Daten bei axSpA
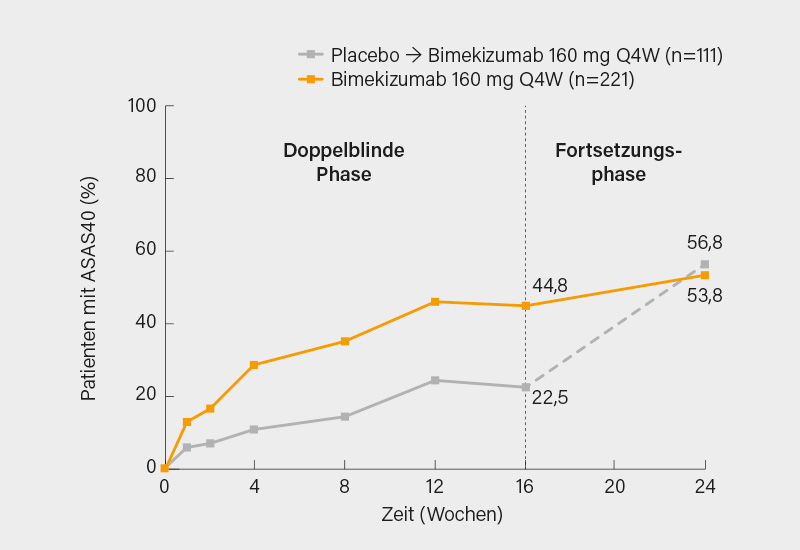
Der IL-17A und F-Inhibitor Bimekizumab (BKZ) wurde nach positiven Phase-II-Daten in zwei Phase-III-Studien bei der r-axSpA (=ankylosierende Spondylitis, AS) (BE MOBILE 2) sowie bei nr-axSpA getestet. Die AS-Studie BE MOBILE 2 umfasste eine 16-wöchige doppelblinde, placebokontrollierte Phase und eine 36-wöchige offene Phase. Die Patienten waren ≥18 Jahre alt, erfüllten die modifizierten New York-Kriterien für AS und hatten zum Zeitpunkt des Einschlusses in die Studie eine aktive Erkrankung (BASDAI ≥4, Rückenschmerz ≥4). Die Patienten wurden im Verhältnis 2:1 randomisiert auf BKZ 160 mg alle 4 Wochen (Q4W) oder Placebo (PBO). Ab Woche 16 erhielten alle Patienten BKZ 160 mg Q4W. Die primären und sekundären Wirksamkeitsendpunkte wurden in Woche 16 untersucht. In Woche 16 wurden der primäre (ASAS40: 44,8 % BKZ vs. 22,5 % PBO; p<0,001) und alle sekundären Endpunkte erreicht. Zudem führte BKZ im Vergleich zu PBO zu einer erheblichen Verringerung des CRP in Woche 2 und der Entzündung des Sakroiliakalgelenke und der Wirbelsäule im MRT in Woche 16. Zu Woche 24 hatten ≥50 % der Patienten einen ASDAS <2,1 erreicht und auch der Anteil von Patienten mit ASAS40-Ansprechen stieg noch weiter an. (Abb. 2). (5)
Die nr-axSpA-Studie BE MOBILE 1 hatte ein ähnliches Design und hat gleichzeitig mit der BE MOBILE 2 rekrutiert, sodass Patienten je nach Einschätzung des Röntgenbildes der Sakroiliakalgelenke entweder in die eine oder in andere Studie eingeschlossen werden konnten. Die Patienten waren ≥18 Jahre alt, hatten einen BASDAI ≥4 und Rückenschmerzen ≥4 sowie Sakroiliitis im MRT und/oder erhöhtes CRP zum Zeitpunkt des Einschlusses in die Studie. Zu Woche 16 wurden der primäre (ASAS40: 47,7 % BKZ vs. 21,4 % PBO; p<0,001) und alle sekundären Endpunkte erreicht. Auch in diese Studie führte BKZ zu einer signifikanten Reduktion von objektiven Entzündungszeichen (CRP, aktive Entzündung im MRT). Es gab in beiden Studien keine neuen, besorgniserregenden Sicherheitssignale. (6)
Es ist somit zu erwarten, dass Bimekizumab zeitnah für die axSpA zugelassen wird. Es bleibt jedoch weiterhin unklar, ob die IL-17A/F-Blockade bei Patienten mit axSpA mehr Vorteile bringt als die IL-17A Blockade. Entsprechende Studien werden für die Beantwortung dieser Frage dringlich benötigt.
JAK-Inhibition bei nr-axSpA und bei AS nach bDMARD-Versagen
Neue Daten wurden auf dem Kongress zur JAK-1-Hemmung mit Upadacitinib präsentiert. Bisher ist die Substanz (neben dem Pan-JAK-Inhibitor Tofacitinib) nur für die Indikation AS zugelassen, basierend auf positiven Daten einer Phase-II/III-Studie bei TNFi-naiven AS-Patienten. SELECT-AXIS 2 wurde im Rahmen eines Masterprotokolls durchgeführt, das zwei unabhängige Studien umfasst, eine in einer AS-Population mit unzureichendem Ansprechen auf bDMARDs und eine in einer nr-axSpA-Population. In die nr-axSpA-Studie wurden Erwachsene ≥18 Jahre mit einer klinischen Diagnose von nr-axSpA eingeschlossen (die auch die ASAS-Klassifizierungskriterien für axSpA von 2009 erfüllten, aber nicht das radiologische Kriterium der modifizierten New York-Kriterien für AS), die objektive Anzeichen einer aktiven Entzündung (aktive Entzündung im MRT und/oder positives CRP) aufwiesen, und die bei Studienbeginn einen BASDAI ≥4 und Rückenschmerzen ≥4 auf einer 0-10 NRS hatten. Die Patienten wurden im Verhältnis 1:1 randomisiert und erhielten während eines 52-wöchigen doppelblinden Behandlungszeitraums einmal täglich (QD) oral Upadacitinib (UPA) 15 mg oder PBO. Eine signifikant höhere ASAS40-Ansprechrate (der primäre Endpunkt) in Woche 14 wurde mit UPA gegenüber PBO erreicht (45 gegenüber 23 %; p<0,0001). Eine statistische Signifikanz wurde auch bei den meisten sekundären Endpunkten (außer BASMI und MASES) in Woche 14 für UPA im Vergleich zu PBO erreicht. (7)
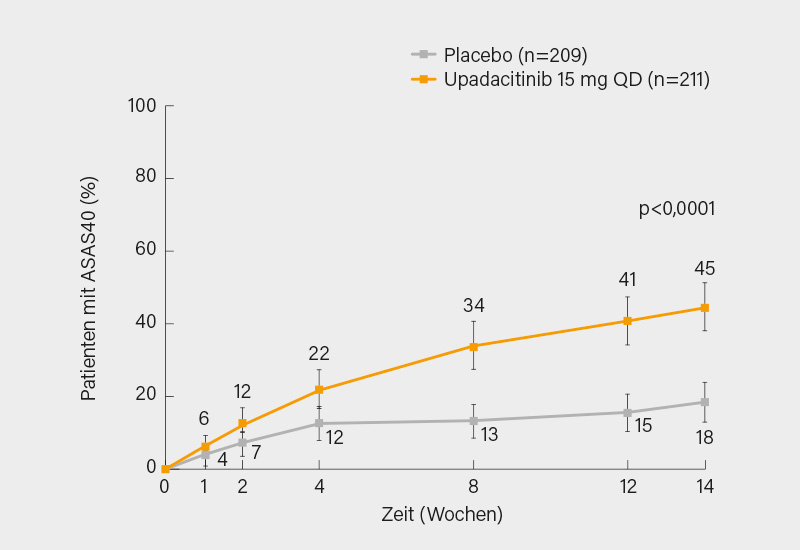
In die AS bDMARD-IR-Studie wurden Erwachsene ≥18 Jahre mit AS eingeschlossen, die die modifizierten New York-Kriterien für AS erfüllten, bei Studienbeginn einen BASDAI ≥4 und Rückenschmerzen ≥4 auf einer 0-10 NRS aufwiesen und ein unzureichendes Ansprechen (oder Intoleranz) auf ein oder zwei bDMARDs (TNF-Inhibitor oder IL-17-Inhibitor) hatten. Die Patienten wurden im Verhältnis 1:1 randomisiert und erhielten während des 14-wöchigen doppelblinden Behandlungszeitraums QD oral UPA 15 mg oder PBO. Signifikant mehr Patienten erreichten den primären Endpunkt des ASAS40-Ansprechens in Woche 14 mit UPA im Vergleich zu PBO (45 vs. 18 %; p<0,0001) (Abb. 3). Alle multiplizitätskontrollierten sekundären Endpunkte erreichten bei Woche 14 statistische Signifikanz für UPA gegenüber PBO. Es gab keine neuen Sicherheitssignale. (8)
Somit kann damit gerechnet werden, dass Upadacitinib für die Indikation nr-axSpA bald zugelassen wird. Des Weiteren stellt Upadacitinib eine wirksame Therapieoption nach dem Versagen von bDMARDs bei der r-axSpA (AS) dar.
Bildgebung für die Diagnose der axSpA
Die ASAS-Gruppe hat zwei relevante Sätze von Empfehlungen zur Durchführung und Befundung von Bildgebung (mit einem Fokus auf die MRT) vorgestellt. Beim Verdacht auf axiale SpA werden 4 MRT-Sequenzen in zwei Schnittführungen empfohlen: eine semikoronare T1-gewichtete Sequenz für strukturelle Veränderungen), T2-gewichtete Sequenz mit Fettsuppression (z. B. STIR oder TIRM) für aktive entzündliche Veränderungen, sowie eine erosions-sensitive Sequenz (z. B. 3D Gradient-Echo oder VIBE). Zusätzlich wird eine semiaxiale T2-gewichtete Sequenz mit Fettsuppression empfohlen für eine bessere Darstellung von aktiven entzündlichen Veränderungen in hinteren Gelenksabschnitten. Eine flächendeckende Implementierung dieser Empfehlung in die klinische Routine würde zweifellos die Diagnose und die Differentialdiagnose der axSpA verbessern. (9)
Dr. Torsten Diekhoff präsentierte auf dem Kongress die Ergebnisse einer Initiative zur Standardisierung des Informationsflusses bei der Bildgebung beim Verdacht auf axiale SpA. Die internationale Task Force hat hierzu 6 Empfehlungen zu Bildgebungs-Anfragen und 11 Empfehlungen zum radiologischen Bericht entwickelt. Auch diese Arbeit sollte dazu beitragen, dass die radiologischen Berichte bei Patienten mit (Verdacht auf) axiale SpA standardisierter und klarer für Rheumatologen werden. (10)
Psoriasis-Arthritis: Zwei Phase-III-Studien zu IL-17A/F-Blockade
Auf dem Kongress wurden zwei wichtige Phase-III-Studien zur IL-17A und F-Blockade mit Bimekizumab bei PsA vorgestellt. Die BE OPTIMAL Studie wurde als Late Breaking Abstract vorgestellt. Diese Studie umfasste eine 16-wöchige doppelblinde, placebokontrollierte und eine 36-wöchige therapieblinde Phase. Die eingeschlossenen Patienten waren ≥18 Jahre alt, bDMARD-naiv und hatten eine aktive PsA mit ≥3 schmerzhaften und ≥3 geschwollenen Gelenken. Die Patienten wurden im Verhältnis 3:2:1 randomisiert auf BKZ 160 mg Q4W, PBO oder Adalimumab (ADA; Referenzarm) 40 mg Q2W. Ab Woche 16 erhielten die PBO-Patienten BKZ 160 mg Q4W. Den primären Endpunkt – ein ACR50-Ansprechen in Woche 16 – erreichten 43,9 % Patienten unter BKZ vs. 10,0 % unter PBO (p<0,001), unter ADA waren es 45,7 %. (11) Interessanterweise ähneln diese Studiendaten den Ergebnissen von Head-to-Head-Studien mit IL-17A Inhibitoren (Ixekizumab vs. Adalimumab und Secukinumab vs. Adalimumab) mit besserem Hautansprechen unter der IL-17-Blockade (PASI 90), aber vergleichbarem muskuloskelettalen Ansprechen (ACR50) auf die IL-17- und TNF-Blockade.
Auch nach einem TNF-Versagen kann man mit einem guten Ansprechen auf die IL-17A/F- Blockade rechnen, wie eine weitere Studie mit Bimekizumab (BE COMPLETE) zeigte. In die Studie wurden erwachsene (≥18 Jahre) Patienten mit aktiver PsA (≥3 schmerzhafte und ≥3 geschwollene Gelenke) eingeschlossen, die auf eine Vorbehandlung mit 1 oder 2 TNF-Inhibitoren nur unzureichend angesprochen oder diese nicht vertragen hatten. Die Patienten wurden im Verhältnis 2:1 auf BKZ 160 mg Q4W oder PBO randomisiert. Nach 16 Wochen wurden unter Bimekizumab der primäre Endpunkt (ACR50: 43,4 % BKZ vs. 6,8 % PBO; p<0,001) und alle sekundären Endpunkte erreicht. (12)
Nachdem in allen auf dem EULAR zu Bimekizumab präsentierten Phase-III-Studien keine relevanten Sicherheitssignale auftraten (auch Candidiasis scheint kein großes Problem zu sein), ist auch hier von einer zügigen Zulassung auszugehen. Auch bei PsA wäre ein direkter Vergleich mit IL-17A-Inhibitoren hilfreich.
Ein neuer IL-17 Inhibitor bei der PsA
Izokibep ist ein kleines Molekül, das in der Lage ist, eine Antikörper-ähnliche Blockade von IL-17A zu erzielen. Eine relativ kleine Größe (etwa ein Zehntel der Antikörper-Größe) kann mit einigen (potentiellen) Vorteilen einhergehen, wie z. B. einer besseren Gewebegängigkeit und einer geringeren Immunogenität. Dr. Frank Behrens präsentierte in Kopenhagen eine Phase-II-Studie zu Izokibep bei PsA. In der prospektiven, multizentrischen, randomisierten, doppelblinden, placebokontrollierten Parallelgruppen-Dosisfindungsstudie wurden 80 mg oder 40 mg Izokibep (Q2W) s.c. im Vergleich zu Placebo bis Woche 16 und dosisgesteuert bis Woche 46 verabreicht. Die Patienten mussten ≥3 geschwollene und ≥3 schmerzhafte Gelenke sowie ein unzureichendes Ansprechen auf eine vorangegangene Therapie mit NSAR, einem csDMARD oder TNF-Inhibitor aufweisen. In Woche 16 betrug die ACR50-Ansprechrate 52 % in der Izokibep 80 mg-Gruppe, 48 % in der 40 mg-Gruppe und 13 % in der Placebogruppe. (13) Von einer Weiterentwicklung von Izokibep in Phase-III ist auszugehen.
Prof. Dr. med. Denis Poddubnyy
Leiter der Rheumatologie am Campus Benjamin Franklin – Medizinische Klinik für Gastroenterologie,
Infektiologie und Rheumatologie
Charité – Universitätsmedizin Berlin
Hindenburgdamm 30, 12203 Berlin
Quellen: 1 Ramiro S et al., Update of the ASAS/EULAR Recommendations on the management of axial spondyloarthritis - EULAR Recommendations session, 1. Juni 2022 | 2 Navarro-Compán V et al., Ann Rheum Dis 2022; 81(Suppl 1): 95-96 (Abstr. OP0148) | 3 Proft F et al., Ann Rheum Dis 2022; 81(Suppl 1): 11 (Abstr. OP0018) | 4 Torgutalp M et al., Ann Rheum Dis 2022; 81(Suppl 1): 14-15 (Abstr. OP0021) | 5 van der Heijde D et al., Ann Rheum Dis 2022; 81(Suppl 1): 12-13 (Abstr. OP0019) | 6 Deodhar A, et al., Ann Rheum Dis 2022; 81(Suppl 1): 772-773 (Poster POS0939) | 7 Deodhar A et al., Ann Rheum Dis 2022; 81(Suppl 1): 9-10 (Abstr. OP0016) | 8 van der Heijde D et al., Ann Rheum Dis 2022; 81(Suppl 1): 403-403 (Poster POS0306) | 9 Lambert R et al., Ann Rheum Dis 2022; 81(Suppl 1): 802-803 (Poster POS0989) | 10 Diekhoff T et al., Ann Rheum Dis 2022; 81(Suppl 1): 97 (Abstr. OP0150) | 11 McInnes I et al., Ann Rheum Dis 2022; 81(Suppl 1): 206-207 (Abstr. LB0001) | 12 Merola JF et al., Ann Rheum Dis 2022; 81(Suppl 1): 167-169 (Abstr. OP0255) | 13 Behrens F et al., Ann Rheum Dis 2022; 81(Suppl 1): 170-171 (Abstr. OP0258)