Zunächst sei auf eine Auswertung des deutschen COVID-19 Rheuma-Registers durch Anne Regierer, Berlin, und Kollegen eingegangen, die dem Einfluss von antirheumatischen Therapien, speziell TNFα- (TNFi) und Januskinase (JAK)-Inhibitoren (JAKi) sowie Rituximab, auf das Ergebnis von SARS-CoV-2-Infektionen bei Patienten mit entzündlich-rheumatischen und muskuloskelettalen Erkrankungen (RMD) auf den Grund gingen. In die vorab publizierte Analyse gingen 2.274 RMD-Patienten ein. Es wurden drei Gruppen verschiedener Schweregrade gebildet: nicht hospitalisiert, hospitalisiert, aber keine invasive Beatmung erforderlich, und invasiv beatmet oder verstorben. Es kam zu 83 Todesfällen, was einer Fallsterblichkeit von 3,6 % entsprach. In einer ordinalen Regressionsanalyse waren Alter, männliches Geschlecht, kardiovaskuläre Erkrankungen, Hypertonie, chronische Lungen- und Nierenerkrankungen unabhängig mit einem schlechten Outcome assoziiert. Im Vergleich war das Outcome von Patienten mit Psoriasis-Arthritis (PsA) besser als jener mit rheumatoider Arthritis (RA). Die Krankheitsaktivität (selbst ohne Glukokortikoide, GK) und GK waren erneut mit der Schwere der Infektion assoziiert.
Auch JAK-Inhibitoren erhöhen Risiko
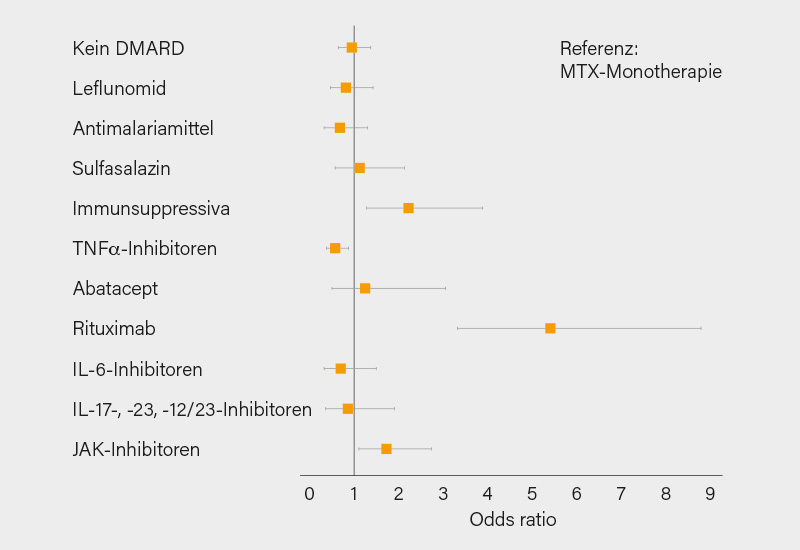
Für die Analyse der einzelnen Medikationen wurde eine Methotrexat (MTX)-Monotherapie als Referenz gewählt. Im Vergleich waren TNFi (Odds ratio, OR 0,6) mit einem besseren Outcome assoziiert, im Gegensatz zu Immunsuppressiva (IS; Mycophenolat Mofetil, Azathioprin, Cyclophosphamid, Ciclosporin) (OR 2,2). JAKi (OR 1,8) und Rituximab (OR 5,4) waren unabhängig mit einem schlechteren Outcome der SARS-CoV-2-Infektion assoziiert (Abb.) – die Daten des COVID-19 Global Rheumatology Alliance (GRA)-Registers bestätigend. Nicht bestätigt wurden hingegen die Bedenken bezüglich Sulfasalazin, womöglich aufgrund homogenerer Daten als im globalen Register. Ein residualer Bias – unterschätzte Komorbiditäten oder kumulative Therapieeffekte – ist aber nicht auszuschließen. Auf jeden Fall ist eine sorgfältige Risiko/Nutzen-Abwägung vor allem bestimmter Medikamente (manche IS, JAKi, Rituximab und andere B-Zell-depletierende Therapien) erforderlich. (1, 2)
Mit dem Risiko von JAKi im Vergleich zu TNFi beschäftigten sich Rebecca Hasseli, Bad Nauheim/Gießen, und Kollegen. Von den 982 im deutschen COVID-19 Rheuma-Register erfassten RA-Patienten waren 128 auf einem JAKi und 190 auf einem TNFi. Zusätzlich GK nahmen 50 % (JAKi) bzw. 31 % (TNFi) der Patienten ein (p<0,001), zusätzlich csDMARD 29 bzw. 49 % (p<0,001). Eine mäßige oder hohe Krankheitsaktivität vor der Infektion lag öfter bei den JAKi- als TNFi-Patienten vor (p=0,042). Das Risiko für Hospitalisierung und Tod steigernde Komorbiditäten wie kardiovaskuläre Erkrankungen oder Hypertonie fanden sich ebenfalls häufiger in der JAKi-Gruppe. Eine COVID-19 bedingte Hospitalisierung war mit 33 vs. 13 % bei JAKi- gegenüber TNFi-Patienten ebenso häufiger erforderlich wie eine O2-Gabe mit 25 vs. 7 % (je p<0,001). Es verstarben 8 gegenüber 0 Patienten in der JAKi- und TNF-Gruppe (p<0,001). Diese Unterschiede sind bemerkenswert, jedoch ist zu beachten, dass die mit JAKi behandelten RA-Patienten ein per se höheres Risiko aufwiesen wie eine höhere Krankheitsaktivität, mehr GK und kardiovaskuläre Komorbiditäten – das letzte Wort dürfte hier noch nicht gesprochen sein. (3)
Impfdurchbrüche bei Rheumapatienten
Eine erste Analyse aus dem GRA-Register zu Impfdurchbrüchen bei RMD-Patienten präsentierten Jean Liew, Boston (USA), und Kollegen. Eingeschlossen wurden 115 voll oder partiell vakzinierte Patienten mit Impfdurchbruch (im Mittel 53 Jahre, 73 % Frauen; 43,5 % mit RA, 13 % SLE und 10 % PsA; 59 % mit mRNA-Vakzine geimpft), von denen 20 % eine mäßige oder hohe Krankheitsaktivität hatten. Häufigste Komorbiditäten waren Hypertonie (30 %), Lungenerkrankungen (21 %) und Adipositas (19 %). Bei den 39 voll vakzinierten RMD-Patienten trat die COVID-19-Infektion im Mittel 86,5 Tage nach der 2. Impfung auf, 29 % mussten hospitalisiert werden. Davon waren je 28 % auf MTX bzw. B-Zell-depletierenden Therapien wie Rituximab, sowie 28 bzw. 23 % auf anderen Antimetaboliten und bDMARDs, die Mehrzahl war nicht auf GK (67 %). Fast immer waren die antirheumatischen Therapien nicht vor bzw. nach der Impfung pausiert worden. Eine solche Unterbrechung gemäß den aktuellen Empfehlungen der DGRh sollte daher dringend erwogen werden. (4)
Die Auswertung einer großen nationalen COVID-19-Kohorte durch Jasvinder Singh, Birmingham (USA), und Kollegen bestätigte, dass Rheumapatienten (n=47.303) im Vergleich zu Nicht-Rheumapatienten (n=536.954) ein erhöhtes Risiko für Durchbruchinfektionen nach vollständiger SARS-CoV-2-Impfung haben. Deren Prävalenz pro 1.000 Personen betrug für Biontech/Pfizer 19 vs. 36, Moderna 16 vs. 33 und Johnson & Johnson 26 vs. 47 bei jenen ohne oder mit RMD. Im Vergleich zu Nicht-Rheumapatienten war das adjustierte Risiko für einen Impfdurchbruch signifikant erhöht bei RA (Odds ratio, OR 1,54), Spondylarthritiden (SpA; OR 1,17), SLE (OR 1,86), systemischer Sklerose (SSc; OR 1,72) und Polymyositis (OR 2,30), nicht aber etwa für Gicht oder Polymyalgia rheumatica. Die Analyse zum Einfluss verschiedener Medikationen steht leider noch aus. (5)
Booster-Impfungen bei Rheumapatienten
Naturgemäß ist die Datenlage zur Effektivität von Booster-Impfungen speziell bei Patienten mit RMD noch limitiert. Gewisse Einblicke gewährt eine kleine randomisierte, verblindete, kontrollierte Studie österreichischer Experten um Michael Bonelli, Wien. Eingeschlossen waren 60 Patienten unter Rituximab, die nach nicht erreichter Serokonversion unter einer Impfung mit den beiden mRNA-Impfstoffen entweder eine homologe Drittimpfung mit der gleichen Vakzine (Biontech/Pfizer bzw. Moderna) oder – eigentlich entgegen den heutigen Empfehlungen – eine heterologe Boosterimpfung (AstraZeneca) erhielten. Im Ergebnis zeigte sich im Hinblick auf den primären Endpunkt der Serokonversionsrate kein signifikanter Unterschied zwischen der Vektor- (n=6/27, 22 %) und mRNA-Drittimpfung (n=9/28, 32 %) (p=0,6). Insgesamt nur 27 % der Patienten serokonvertierten, was die mit Rituximab (und potenziell anderen B-Zell-depletierenden Therapien) verbundene Problematik unterstreicht. Eine spezifische T-Zell-Antwort war dafür sogar häufiger nach der Vektorimpfung mit 100 % (n=20/20) versus 81 % (n=13/16). Eine neu induzierte humorale und/oder zelluläre Impfantwort wurde bei 82 % (n=9/11) erreicht – eine Boosterimpfung ist daher bei zuvor nicht-serokonvertierten RMD-Patienten dringlich zu empfehlen, was allerdings auch für alle übrigen RMD-Patienten auf immunmodulierenden oder IS-Therapien gilt. (6)
Dass Rituximab keineswegs der einzige „Problemfall“ ist, sondern im Grund bei allen B-Zell-depletierenden Therapien die Impfantwort in Abhängigkeit von der Zahl peripherer B-Zellen zum Zeitpunkt der Vakzinierung gefährdet ist, verdeutlicht eine Arbeit von Kyriakos Kirou und Jeffrey Zhang-Sun, New York (USA). Eingeschlossen waren 60 voll vakzinierte (meistens mit einer der mRNA-Vakzine) RMD-Patienten, gut die Hälfte davon mit SLE. Nach im Median 52,5 Tagen hatten 9 (15 %) der Probanden kein, 21 (35 %) ein mäßiges und 30 (50 %) ein gutes humorales Impfansprechen (gemäß ihrem Anti-Spike-Protein-Antikörper-Titer). Bei Patienten mit keinem oder schlechten Ansprechen fielen absolute B-Zell-Zahlen <40/ml auf. 6 Patienten hatten nur Rituximab erhalten (2 binnen 6 Monaten vor der Impfung), bei 7 wurde Rituximab >6 Monate vor der Impfung gefolgt von Belimumab und bei 8 nur Belimumab als B-Zell-depletierende Therapie eingesetzt.
Generell war die B-Zell-Depletion – anders als andere Therapien – mit einem schlechteren Impfansprechen assoziiert. Sowohl für Rituximab als auch Belimumab zeigte sich eine Korrelation von schlechtem Ansprechen und niedrigen B-Zell-Zahlen (<40/ml). In dieser retrospektiven Studie kam es unter der Moderna- im Vergleich zur Biontech/Pfizer-Vakzine häufiger zu adäquaten Anti-Spike-Titern (p=0,0386). Auch im Falle von Belimumab sollten daher die B-Zell-Zahlen beim Timing der Impfung berücksichtigt werden. (7)
Quellen:
1 Arthritis Rheumatol 2021; 73 (Suppl 10): Abstr. 0102
2 RMD Open 2021; 7(3): e001896
3 Arthritis Rheumatol 2021; 73 (Suppl 10): Abstr. 0097
4 ACR Convergence 2021: Poster L04
5 ACR Convergence 2021: Abstr. L16
6 ACR Convergence 2021: Abstr. L17
7 ACR Convergence 2021: Poster L03